
【题目】一定条件下,在密闭容器中发生如下反应:CO(g)+2H2(g)![]() CH3OH(g),若开始时只充入a mol CH3OH蒸气,达到平衡时,混合物的压强比起始时增大了70%;若开始时充入a mol CO和2a mol H2的混合气体,达到平衡时H2的转化率为( )
CH3OH(g),若开始时只充入a mol CH3OH蒸气,达到平衡时,混合物的压强比起始时增大了70%;若开始时充入a mol CO和2a mol H2的混合气体,达到平衡时H2的转化率为( )
A. 30% B. 35% C. 65% D. 70%
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NaCl、AlCl3、FeCl2、FeCl3、MgCl2五种溶液,用一种试剂能加以区别,这种试剂是 ( )
A. KSCN B. BaCl2 C. NaOH D. HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
选项 | 强电解质 | 弱电解质 | 非电解质 |
A | CaCO3 | HF | SO2 |
B | NaCl | NH3 | BaSO4 |
C | Fe | HCl | 蔗糖 |
D | HNO3 | Fe(OH)3 | Cl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2NaClO3 + H2SO4 + SO2===2ClO2 + 2NaHSO4,下列叙述正确的是
A. NaClO3是还原剂 B. SO2被氧化 C. SO2发生还原反应 D. ClO2是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠( NaCl02)是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等。已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2![]() 3H2O,高于38 ℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。纯ClO2易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如下:
3H2O,高于38 ℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。纯ClO2易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如下:
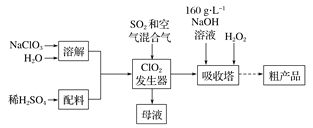
(1) ClO2发生器中的离子方程式为 ,发生器中鼓人空气的作用可能是__________(选填序号)。
a.将SO2氧化成SO3,增强酸性
b.稀释ClO2以防止爆炸
c.将NaClO3还原为ClO2
(2)吸收塔内反应的化学方程式为 ,吸收塔的温度不能超过20℃,其原因是_____________。
(3)从“母液”中可回收的主要物质是 。
(4)从吸收塔中可获得NaCl02溶液,从NaCl02溶液到粗产品(NaClO2)经过的操作步骤依次为:①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥,得到成品。
(5)为测定粗品中NaCl02的质量分数,做如下实验:
准确称取所得亚氯酸钠样品10.00 g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴人适量的稀硫酸,充分反应(ClO2-+ 4I-+ 4H+= 2H2O+ 2I2+ Cl-)。将所得混合液配成250mL待测溶液,取25.00 mL待测液,用2.000 mol.L-lNa2S203标准液滴定(I2+2S2O32-= 2I-+S4O62-),测得消耗Na2SO3溶液平均值为16.40mL。该样品中NaClO2的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组进行“铁与水蒸气”反应的产物及其性质探究系列实验。请回答实验中的问题:

(1)写出该反应的化学方程式__________,若16.8g铁粉参加反应,转移电子数目为_____。
(2)待试管冷却后,取少许其中的固体物质溶于稀盐酸得溶液A,取所得液滴加KSCN溶液,溶液无颜色变化,说明硬质试管中固体物质的成分是_______ 溶液未变红色的原因是___________(用离子方程式表示)。
(3)若要使(2)中所得溶液变红又不增加溶液离子种类,可以加入适量____试剂。
(4)另取(2)中溶液A,加入NaOH溶液,观察到生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色。沉淀转化过程发生的反应方程式为______________。
(5)某催化剂(主要成分FeO、Fe2O3)中+2价铁与+3价铁的物质的量之比为1:2时,其催化活性最高,此时铁的氧化物的混合物中铁的质量分数为________(用小数表示,保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2气体通入BaCl2溶液至饱和,无沉淀生成,再通入另一种气体有沉淀生成,则第二次通入的气体可能是下列气体中的①NO2 ②CO2 ③Cl2 ④HCl ⑤NH3 ⑥ H2S
A. ①②③⑤ B. ①③⑤⑥ C. ①④⑤⑥ D. ②③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com