
| 13 |
| 2 |
| 5800g |
| 58g/mol |
| 2.9×105KJ |
| 50 |
| 13 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、甲酸的结构简式:HO-CHO |
B、一氟甲烷电子式: |
| C、聚丙烯的最简式:CH2 |
| D、次氯酸的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:

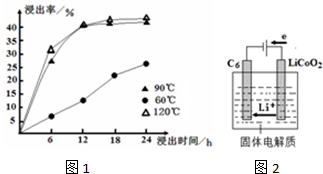
| c(Ca2+) |
| c(Mg2+) |
| ||
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
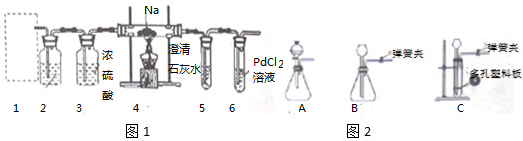
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | |
| 第一电离能(kJ/mol) | 520.2 | 495.8 | 418.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |

| A、H2的燃烧热为241.8kJ?mol-1 |
| B、根据②推知反应H2(g)+O2 (g)=H2O(l);△H>-241.8kJ?mol-1 |
| C、H2(g)转变成H2O(g)的化学反应一定要释放能量 |
| D、由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com