
| 0.6mol |
| 1 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| c(F-) |
| c(H+) |
| A、afh | B、acg |
| C、cf | D、bdh |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 13 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
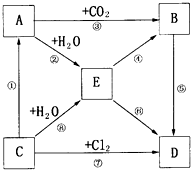 如图表示A--E五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.
如图表示A--E五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、>16 | B、<16 |
| C、=16 | D、不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀释浓硫酸时,将水沿器壁缓慢注入浓硫酸中 |
| B、过滤时,漏斗里液体的液面要高于滤纸的边缘 |
| C、胶头滴管的管口直接伸入试管里滴加液体,以免外溅 |
| D、分液时,上层液体由上口倒出,下层液体由下口放出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com