
【题目】某化学兴趣小组用只含有Al、Fe、Cu的工业废料制取氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),以探索工业废料的再利用。其实验方案如下:
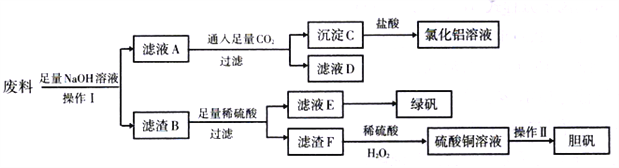
(1)操作I应选择以下装置中的_____________(填正确答案编号)。
(2)滤液D中的溶质主要是________________(写化学式)。
(3)写出沉淀C与盐酸反应的离子方程式:________________。
(4)滤液E露置在空气中一段时间后,检测出溶液中含Fe2+,原因是________________。
(5)写出滤渣F与稀硫酸、H2O2制硫酸铜的反应方程式_______________________,该反应与滤渣F跟浓硫酸直接反应相比,其优点是_________________________________。
(6)操作II步骤有蒸发浓缩、_______________、过滤洗涤、自然干燥。
【答案】 C NaHCO3 Al(OH)3+3H+=Al3++3H2O Fe2+具有强还原性,易被空气中的氧气氧化成Fe3+ Cu+H2SO4+H2O2=CuSO4+2H2O 无污染大气的SO2气体产生 冷却结晶
【解析】(1)操作I得到滤液A和滤渣B,属于过滤,A~D四种操作分别是蒸馏、分液、过滤、蒸发,答案选C。(2)只有铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,即A中含有偏铝酸钠,通入足量二氧化碳生成碳酸氢钠和氢氧化铝,因此滤液D中的溶质主要是NaHCO3。(3)沉淀C是氢氧化铝,与盐酸反应的离子方程式为Al(OH)3+3H+=Al3++3H2O。(4)滤液E最终得到绿矾,说明是硫酸亚铁溶液。由于Fe2+具有强还原性,易被空气中的氧气氧化成Fe3+,所以露置在空气中一段时间后,检测出溶液中含Fe2+。(5)滤渣B中含有铁和铜,铜与稀硫酸不反应,则滤渣F是铜,与稀硫酸、H2O2制硫酸铜的反应方程式为Cu+H2SO4+H2O2=CuSO4+2H2O,该反应与滤渣F跟浓硫酸直接反应相比,其优点是无污染大气的SO2气体产生,且硫酸的利用率高。(6)由溶液制取晶体,需经过加热浓缩,冷却结晶、过滤洗涤、干燥才可得到。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
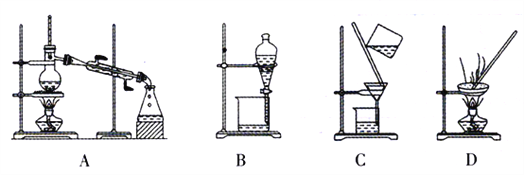
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯可与金属Fe、盐酸反应生成苯胺和FeCl2,反应如下:
![]() +3Fe+6HCl
+3Fe+6HCl![]()
![]() +3FeCl2+2H2O
+3FeCl2+2H2O
(1)写出Fe2+基态核外电子排布式:_______。
(2)苯胺分子中C、N原子的杂化方式分别是________。1mol苯胺分子中含σ键的数目是___。
(3)苯胺与盐酸反应可生成氯化苯胺盐![]() ,氯化苯胺盐中含有的化学键有______。
,氯化苯胺盐中含有的化学键有______。
(4)苯胺在水中的溶解度大于硝基苯,其原因是________。
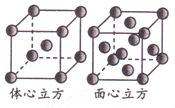
(5)金属铁单质的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则两种晶胞中Fe原子的配位数之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢气燃料电池如下图所示,a、b均为惰性电极。下列叙述不正确的是
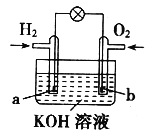
A. 电池总反应方程式为:2H2+O2=2H2O
B. a极是负极,该电极材料不参与电极反应
C. b极反应是:O2+4OH--4e-=2H2O
D. 氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列关于有机物的问题:
(1)下列有机物属于酯类的是_________(填正确答案编号)。
A. ![]() B.
B. ![]() C.
C. ![]() D.CH3CH2OH
D.CH3CH2OH
(2)下列有机物不能发生水解反应的是__________(填正确答案编号)
A.油脂 B.葡萄糖 C.纤维素 D.蛋白质
(3)下列有机物属于芳香族化合物的是____(填正确答案编号,下同),与环己烷互为同系物的是_____,能使溴的四氯化碳溶液褪色的是___________;D和H2反应的化学方程式是____________。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 铅蓄电池放电时负极质量减轻,充电时阳极质量增加
B. 同温下,0.1 mol·L-1醋酸溶液pH=a,0.01 mol·L-1醋酸溶液pH=b,则a+1<b
C. 钢铁水闸可用牺牲阳极的阴极保护法或外加电流的阴极保护法进行防护
D. 一定条件下反应N2+3H2![]() 2NH3,当3v正(H2)=2v逆(NH3),则反应达到平衡
2NH3,当3v正(H2)=2v逆(NH3),则反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰氧基胡椒酚乙酸酯(F)具有抗氧化性、抗肿瘤作用,其合成路线如下:
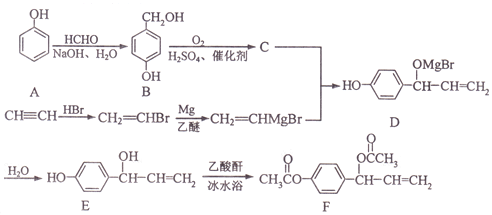
已知:RMgBr![]()
(1)化合物F中含氧官能团的名称为______。
(2)A-B的反应类型为_______。
(3)化合物C的结构简式为______。
(4)1mol化合物E与足量乙酸酐[(CH3CO)2O]反应,除F外另一产物的物质的量为_______。
(5)写出同时满足下列条件的E的一种同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应; ②能发生银镜反应;
③核磁共振氢谱显示有4种不同化学环境的氢,其峰面积比为6:2:1:1。
(6)请以甲苯和乙醛为原料制备![]() ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______________
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作不能用于检验NH3的是( )
A.气体使湿润的酚酞试纸变红
B.气体能使湿润的红色石蕊试纸变蓝
C.气体与蘸有浓H2SO4的玻璃棒靠近
D.气体与蘸有浓盐酸的玻璃棒靠近
查看答案和解析>>
科目:高中化学 来源: 题型:
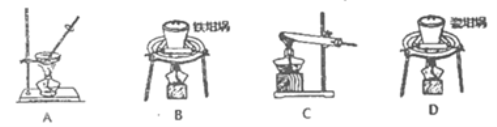
【题目】以冶炼金属铝的废弃物铝灰为原料制取超细α-氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
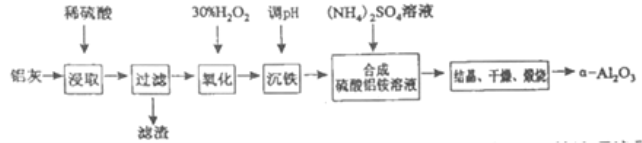
(1)用上图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为____(填选项编号).
(2)流程中加入H2O2有气体产生,原因是___________。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3.己知:
Fe3+ | Fe2+ | Al3+ | |
开始沉淀时的pH | 2.2 | 7.5 | 3.7 |
完全沉淀时的pH | 3.2 | 9.0 | 4.7 |
为保证产品的纯度,可以选用下列物质中的____调节溶液pH(填字母),调节pH的范围为_____。
a.A12O3 b.NaOH c.Al(OH)3 d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O] ![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
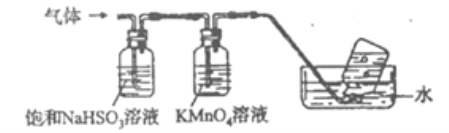
①集气瓶中收集到的气体是______(填化学式).
②装有KMnO4溶液洗气瓶的作用是________。
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂_________,写出硫酸铝铵加入足量该试剂的离子方程式_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com