
【题目】勒夏特列原理在生产生活中有许多重要应用。完成下列填空:
(1)实验室配置FeCl3溶液时,将FeCl3溶解在盐酸中,目的是防止________________________。
(2)石蕊(用HZ表示)试液中存在的电离平衡HZ(红色)![]() H++Z—(蓝色)。在中性溶液中。石蕊试液呈__________色;要使石蕊试液呈红色,可加入____________________________。
H++Z—(蓝色)。在中性溶液中。石蕊试液呈__________色;要使石蕊试液呈红色,可加入____________________________。
(3)工业制硫酸时,为使SO2尽可能多地转化成SO3,采取的措施是_______________________。
(4)合成氨工业采取的以下措施中,可以用勒夏特列原理解释的是_________(选填编号)。
a.升温至500℃左右 b.使用催化剂
c.加压至20~50MPA. d.将氨及时液化分离
【答案】FeCl3发生水解 紫 酸 使用过量的空气(或使用热交换器,移走热量) cd
【解析】
(1)配制氯化铁溶液需要防止铁离子水解而变浑浊;
(2)酸碱指示剂存在电离平衡,根据加入的电解质溶液是促进指示剂电离还是抑制指示剂电离,如果促进指示剂电离,溶液呈蓝色,如果是抑制指示剂电离溶液就呈红色,从而确定溶液的颜色和加入的物质;
(3)根据平衡移动原理结合增加反应物的转化率知识来回答;
(4)勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用。
(1)铁离子在溶液中水解,所以实验室中配制FeCl3溶液时通常需要向其中加盐酸抑制Fe3+水解;
(2)根据平衡:HZ(红色)═H++Z-(蓝色),在中性溶液中该指示剂试液显示本身紫色,要使该指示剂试液呈红色,平衡逆向移动即可,可以加入酸;
(3)工业制硫酸时,为使SO2尽可能多地转化成SO3,增加二氧化硫的转化率,可以采取的措施是用足量的氧气;
(4)a.合成氨反应为放热反应,升高温度不利用平衡向正方向移动,但升温却可提高反应速率,催化剂活性大,与勒沙特列原理不符,故a不符合;
b.用铁触媒加快化学反应速率,是利用铁触媒做催化剂降低反应的活化能,加快反应速率,不改变化学平衡,不能用勒夏特列原理解释,故b不符合;
c.反应是气体体积减小的反应,加压平衡正向进行符合化学平衡移动原理,可以用勒夏特列原理解释,故c符合;
d.将生成的氨液化并及时从体系中分离出来,减少生成物浓度,平衡正向进行,可以用勒夏特列原理解释,故d符合;
故答案为cd。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,向0.1 mol/L的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是
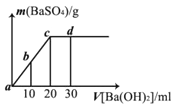
A. 溶液的pH:a<b<c<d
B. 溶液的导电能力:a>b>d>c
C. a、b溶液呈酸性
D. c、d溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为: Ni(s)+4CO(g) ![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断不正确的是
A. 该反应达到平衡时,v分解[Ni(CO)4]=4v消耗(CO)
B. 第一阶段应选择稍高于42.2℃的反应温度
C. 第二阶段,230℃时Ni(CO)4分解率较高
D. 其他条件不变,增加c(CO),平衡向正向移动,反应的平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将下列现象中硫酸表现出来的性质填写在空格内:敞口放置的浓硫酸,溶液质量增加_________________;浓硫酸与蔗糖放出大量热,并出现黑色固体____________;
(2)将一瓶二氧化硫和一瓶硫化氢气体瓶口对接进行混合,瓶壁上能观察到有_________________和_________________生成,其化学反应方程式为:____________________________ , 此反应中SO2作____________剂, 1 mol 二氧化硫和硫化氢完全反应时,有_________mol电子发生转移。
(3)当雨水的pH________时,我们称之为“酸雨”。某环保小组测定某次雨水中硫酸的物质的量浓度为5×10-6 mol/L,这次雨__________酸雨(选填“属于”或“不属于”)。常温下若把0.1mol/L的盐酸溶液稀释100倍,此时的溶液的pH=__________。
(4)将一充满氨气的大试管倒立在水槽中,可以看到现象_________________,说明_______________,若在此溶液中滴入酚酞试液,溶液呈_______色,其电离方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有着广泛的应用。下图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
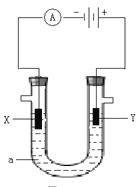
(1)若用U型管电解滴有酚酞的饱和食盐水,电解一段时间后,_________极(选填X或Y)附近溶液呈红色, Y极产生的现象是______________________,电解前溶液的pH_______7(填“大于”、“小于”或“等于”,下同),电解后溶液的pH_________7。
(2)写出电解饱和食盐水的化学方程式____________________________________________ 。
(3)若a是CuCl2溶液,则Y极上的产物是____________。X极现象____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化学的认识中,正确的是()
A. CH3CH=CHCH3分子中的四个碳原子可能在同一直线上
B. 淀粉和纤维素属于多糖, 均可在在人体内水解转化为葡萄糖,为人类提供能量
C. 分子式为 C4H8O且能和金属钠反应的有机物共有三种(不考虑立体异构)
D. 分枝酸结构简式如图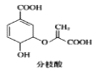 ,可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
,可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知有机物A的分子式为C5H11Br,且不能发生消去反应,则A的结构简式为_______;
(2)已知有机物A的分子式为C7H8O2,有机物A的结构有多种:若A可与FeCl3溶液发生显色反应,且1 mol的A可与2 mol的Na2CO3反应,则A共有______种,其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构有两种,它们的结构简式分别为___________、____________。
(3)已知烯烃能被酸性KMnO4溶液氧化,![]()
1mol的某烃A完全燃烧生成5molCO2和4molH2O,则A的分子式为_____,若该烃用酸性KMnO4溶液氧化后得到HOOCCH2CH2CH2COOH,由此推断该烃的结构的结构简式:__________;若A的一氯代物只有一种,则A的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是
A. 常温常压下,1.8g甲基(—CD3)中含有的中子数为NA
B. 标准状况下,11.2L乙烯和环丙烷(C3H6)的混合气体中,共用电子对的数目为3NA
C. 2.8g 的聚乙烯中含有的碳原子数为0.2 NA
D. 1mol 苯中含有碳碳双键的数目为3 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com