
【题目】甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,A、G的焰色反应为黄色。在一定条件下,各物质相互转化关系如右图。请回答:

(1)写化学式:丙____,E________
(2)X的电子式为_____________。
(3)写出反应⑥的化学反应方程式:______________________________________。
(4)写出B与G溶液反应生成F的离子方程式:____________________________。
【答案】O2 SO3 ![]() Na2O2+SO2=Na2SO4 HCO3- + OH-==CO32- + H2O
Na2O2+SO2=Na2SO4 HCO3- + OH-==CO32- + H2O
【解析】
甲、乙、丙为常见单质,甲、乙均可在丙中燃烧,则丙为氧气,乙、丙两元素在周期表中位于同一主族,乙为S,D为二氧化硫,E为三氧化硫;A、G的焰色反应为黄色,说明其中含有Na元素,故甲为Na,X为硫化钠,A和X的摩尔质量相同,A为过氧化钠,A与二氧化碳反应生成氧气和F,F为碳酸钠,A与水反应生成氧气和B,B为氢氧化钠,则G为碳酸氢钠;A与D反应生成C,B与E反应也生成C,故C为硫酸钠。
(1)根据上述分析,丙为O2,E为SO3;
(2)X为硫化钠,电子式为![]() ,注意不要漏掉S周围的电子,不要漏掉中括号;
,注意不要漏掉S周围的电子,不要漏掉中括号;
(3)反应⑥为过氧化钠与二氧化硫反应生成硫酸钠,方程式为Na2O2+SO2=Na2SO4;
(4)B与G溶液反应生成F的离子方程式为HCO3- + OH-==CO32- + H2O。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温密闭容器发生可逆反应:Z(?)+W(?)![]() X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件。下列有关说法中正确的是
X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件。下列有关说法中正确的是

A. Z和W在该条件下有一种可能为气态
B. t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等。
C. 若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
D. 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种染料敏化太阳能电池的示意图。电池的一个电极由有机光敏染料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
TiO2/S ![]() TiO2/S*(激发态)
TiO2/S*(激发态)
TiO2/S* → TiO2/S++e-
I![]() +2e-→ 3I-
+2e-→ 3I-
2TiO2/S++3I-→ 2TiO2/S+I3-
下列关于该电池叙述不正确的是
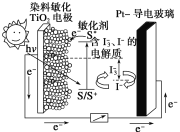
A. 电池工作时,I-在镀铂导电玻璃电极上放电
B. 电池工作时,是将太阳能转化为电能
C. 电池的电解质溶液中I-和I![]() 的浓度不会减少
的浓度不会减少
D. 电池中镀铂导电玻璃为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72LH2(已折算成标准状况),甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25g/L。请回答下列问题:
(1)甲的化学式是__________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________。
(3)气体丙与金属镁反应的产物是__________(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式__________。有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之__________(已知Cu2O+2H+=Cu+Cu2++H2O)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)为原料制取铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:
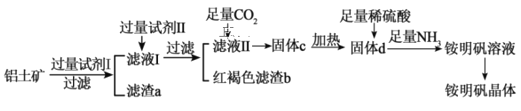
请回答下列问题:
(1)试剂I为__________;试剂Ⅱ为____________;滤渣a的化学式为__________。
(2)证明铁元素已全部转化为滤渣b的实验方法是_______________________________。
(3)滤液Ⅱ中通入足量CO2进行酸化,从而得到固体c,若用盐酸进行酸化是否可以?____,请说明理由:___________________________________________________________。
(4)由固体d制取铵明矾溶液的化学方程式为________________________________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)蒸发浓缩、冷却结晶、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表和元素周期律的说法错误的是( )
A. 因为Na比K容易失去电子,所以Na比K的还原性强
B. 第二周期元素从Li到F,非金属性逐渐增强
C. IA族元素Li、Na、K的原子核外电子层数随着核电荷数的增加而增多
D. ⅥA族元素O、S、Se的位置从上至下,故![]() 、
、![]() 、
、![]() 稳定性依次减弱
稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向1L 0.1mol/L的一元酸HR溶液中逐渐通入氨气(已知25℃时一水合氨的电离平衡常数为K=1.76×10-5),保持溶液的温度和体积不变,混合溶液的pH与粒子浓度比值的对数变化关系如图所示。下列叙述错误的是
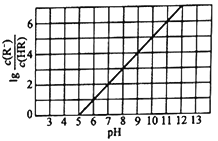
A. 25℃时,0.1mol/L的一元酸HR的电离平衡常数为Ka=10-5
B. 当通入0.1mol氨气时,c(NH4+)>c(R-)>c(OH-)>c(H+)
C. 当c(R-)=c(HR) 时,溶液为酸性
D. HR为弱酸,25℃时随着氨气的通入,c (R-)/[c(OH)c (HR)] 逐渐增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com