
【题目】对H2O的电离平衡不产生影响的粒子是
A. ![]() B. 26Fe3+ C.
B. 26Fe3+ C.  D. CH3COO-
D. CH3COO-
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:
【题目】(15分)煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为 和
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:

这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为 ;第二步反应的离子方程式为 。
(3)工业煤干馏得到的产品有焦炭、 、 等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:______________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:_________________________
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是____________________________________ 。
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。①石膏的化学式为_______________。②图像中AB段对应化合物的化学式为_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的叙述正确的是
A. 室温下,pH均为4的H2SO4、(NH4)2SO4的溶液中,水的电离程度相同
B. 室温时,Ka=1×10-5浓度为0.1 mol/L的HA溶液,pH≈3
C. 在饱和AgCl、AgBr的混合溶液中加入少量AgNO3溶液 增大
增大
D. 25℃时,向20 mL 0.01 mol/L的醋酸溶液中滴加10 mL 0.01 mol/L的KOH溶液,混合溶液后呈酸性:c(K+) + c(H+)<c(CH3COOH) + c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B3C+4D中,表示该反应速率最快的是( )
A. v(A)=0.7molL﹣1S﹣1
B. v(B)=0.3 molL﹣1S﹣1
C. v(C)=0.8molL﹣1S﹣1
D. v(D)=1 molL﹣1S﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.移取20mL待测盐酸注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上1~2cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)__________AF。
(2)上述B步骤操作的目的是_____________。
(3)在进行C步操作滴定前排气泡时,应选择下图2中的___________(填序号),若用25mL滴定管进行实验,当滴定管中的液面在“10”处,则管内液体的体积(填序号)____________(①=10mL,②=15mL,③<10mL,④>15mL)。

(4)判断以下操作,对测定结果盐酸浓度的影响(填“偏高”、“偏低”或““无 影响”)
①上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是__________。
②若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结果产生的影响是____________。
③如果滴定前装有待测溶液的酸式滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的镁、铝合金与硝酸恰好完全反应,得到硝酸盐溶液和NO2、N2O4、NO的混合气体,将这些气体与标准状况下3.36 L O2混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸盐溶液中加入2 mol/L NaOH溶液至沉淀最多时停止加入,将沉淀滤出,向滤液中加水稀释至500 mL,此时所得溶液的物质的量浓度为( )
A. 0.5 mol/LB. 1 mol/L
C. 1.2 mol/LD. 2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,A、G的焰色反应为黄色。在一定条件下,各物质相互转化关系如右图。请回答:

(1)写化学式:丙____,E________
(2)X的电子式为_____________。
(3)写出反应⑥的化学反应方程式:______________________________________。
(4)写出B与G溶液反应生成F的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知3H2(g)+N2(g)![]() 2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率v(N2)=__。
(2)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。N![]() N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中__(填“吸收”或“放出”)的能量为__。
N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中__(填“吸收”或“放出”)的能量为__。
(3)为加快反应速率,可以采取的措施是__。
a.降低温度 b.增大压强 c.恒容时充入He气 d.恒压时充入He气 e.及时分离NH3
(4)CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2)。科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)![]() C(ads)+2H2(g)(慢反应)
C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)![]() 2CO(g)(快反应)
2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
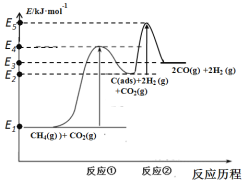
CH4与CO2制备“合成气”的热化学方程式为___。能量变化图中:E5+E1___E4+E2(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。向该溶液中加入一定物质的量浓度的NaOH溶液时,生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是
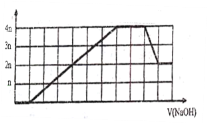
A. 原溶液中一定含有的阳离子是H+、NH4+、Mg2+、Al3+
B. 原溶液中一定含有SO42-和Na+
C. 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D. 反应最后形成的溶液中含有的溶质仅为Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com