
【题目】高炉炼铁过程中发生的主要反应为:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g);在1000℃时,平衡常数为4.0;在1300℃时,平衡常数为3.5。下列说法中,正确的是( )
Fe(s)+CO2(g);在1000℃时,平衡常数为4.0;在1300℃时,平衡常数为3.5。下列说法中,正确的是( )
A. 平衡常数的表达式为:K=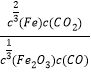
B. 在1000℃时,10L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1mol,10min达到平衡,υ(CO2)=0.006mol/(L·min)
C. 一段时间以后,铁的量不再变化,不能说明该反应达到平衡
D. 下图表示不同温度下,CO的转化率与时间关系图像
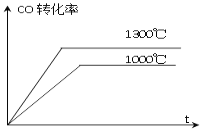
【答案】B
【解析】
A.反应为:1/3 Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g);平衡常数的表达式为:K=c(CO2)/c(CO), A错误;
2/3Fe(s)+CO2(g);平衡常数的表达式为:K=c(CO2)/c(CO), A错误;
B. 在1000℃时,令平衡时CO的物质的量变化为nmol,容器的体积为10L;则:
1/3 Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
起始量 1 1
变化量 n n
平衡量 1-n 1+ n
K=c(CO2)/c(CO)= [(1+ n)÷10]/[(1-n)÷10]=4, n=0.6mol, υ(CO2)=0.6/(10×10)= 0.006mol/(L·min), B正确;
C. 反应的不断进行,铁的量就在发生变化,一段时间以后,铁的量不再变化,说明该反应达到平衡状态,C错误;
D. 在1000℃时,平衡常数为4.0;在1300℃时,平衡常数为3.5,温度升高,平衡常数减小,所以该反应正反应为放热反应,升高温度,速率加快,平衡左移,CO的转化率应该降低,而图示的结果正好相反,D错误;
正确选项B。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】设NA 代表阿伏加德罗常数的数值,下列说法正确的是( )
A. 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA
B. 标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA
C. 标准状况下,NA个SO3分子所占的体积约为22.4 L
D. 将0.1mol氯化铁溶于水配成1L溶液,所得溶液含有0.1NA Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,某研究性学习小组用下图装置进行“草酸晶体受热分解的部分产物的验证”的实验。请回答下列问题。

【资料查阅】
①草酸晶体在101 ℃时开始熔化,150 ℃时开始升华,175 ℃时开始分解;
②草酸钙和草酸氢钙均为白色不溶物。
(1)按照如图所示的装置,通过实验检验草酸晶体的部分分解产物,装置B中可观察到有气泡冒出且澄清石灰水变浑浊,由此甲同学判断草酸晶体分解的产物中有CO2。但立即遭到乙同学反对,其反对的理由可能是______________________________________。
(2)丙同学认为草酸晶体分解的产物中含有CO,为进行验证,X应选用________(填化学式)浓溶液,装置D的作用是____________________。
(3)实验过程中涉及如下操作:①点燃装置A处的酒精灯;②熄灭装置A处的酒精灯;③点燃装置E处的酒精灯;④熄灭装置E处的酒精灯。这4步操作由先到后的顺序为____________(填序号)。点燃E处酒精灯前必须要进行的操作是______________。
(4)实验过程中发现装置E中黑色粉末变红色,装置F中有黑色固体生成,经检测装置F中的固体为金属单质,则装置F中发生反应的化学方程式为________________________________________________________________________。
(5)丁同学用滴定法测定草酸晶体中结晶水的含量,进行了下列操作:
步骤一:用分析天平称取3.15 g纯净的该草酸晶体,配制成250 mL溶液。
步骤二:用移液管移取25.00 mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化。
步骤三:取0.100 mol·L-1标准酸性KMnO4溶液,进行滴定,三次结果如下表所示:
第一次 | 第二次 | 第三次 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知滴定反应的离子方程式为:MnO![]() +H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)。
+H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)。
①配制草酸溶液的操作步骤依次是:将晶体置于烧杯中,加水溶解,将溶液转移入________,洗涤,定容,摇匀。
②通过计算确定x=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z三种主族元素在元素周期表中的位置如图所示。设X的原子序数为a,则下列说法不正确的是( )

A. Y的原子序数可能为a-17 B. Z的原子序数可能为a+31
C. X、Y、Z可能为短周期元素 D. Y与Z的原子序数之和可能为2a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,X与M同主族,Z的气态氢化物能与其最高价氧化物的水化物反应,G是地壳中含量最高的金属元素。清回答下列问题:
(1)Q的元素符号为______,Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号)_______。
(2)Y在元素周期表中的位置为_______________,Y与硫元素形成的二元化合物的电子式为_________________________。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式)_____________。
(4)单质Y和元素Z的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为_________。
(5)Z和G组成的化合物GZ,被大量用于制造电子元件。工业上用G的氧化物、Y单质和Z单质在高温下制备GZ,其中G的氧化物和Y单质的物质的量之比为1∶3,则该反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】龙葵醛( )是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一种合成路线(部分反应条件及副产物已略去):
)是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一种合成路线(部分反应条件及副产物已略去):

(1)龙葵醛的分子式为_______,其中官能团的名称是__________;
(2)A物质的核磁共振氢谱中有_______个吸收峰,B的结构简式可能为_______。
(3)反应③的反应类型为_______,反应⑤的反应条件为_______。
(4)反应⑥的化学方程式为___________。
(5)龙葵醛具有多种同分异构体,其中某些物质有下列特征:a.其水溶液遇FeCl3溶液呈紫色;b.能与Br2的CCl4发生加成反应。则符合上述条件的物质可能的结构有_______种。其中核磁共振氢谱为五组峰,峰面积比为1∶2∶2∶2∶3的结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼铁高炉中发生的基本反应之一为FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH>0。下列说法错误的是( )
Fe(s)+CO2(g) ΔH>0。下列说法错误的是( )
A. 升高温度,平衡移动后达到新的平衡时平衡常数增大
B. 将高炉加高后,达到平衡时平衡常数增大
C. 将矿石粉碎不能使平衡常数增大
D. 平衡常数越大,尾气中CO含量越少,CO2含量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化石燃料开采、加工过程产生的H2S 废气制取氢气,既价廉又环保。
⑴工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为____________;
②常温下,不能与M单质发生反应的是____________(填序号);
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法 已知:H2S(g) ![]() H2(g)+1/2S2(g)
H2(g)+1/2S2(g)
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图1。曲线a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。根据图像回答下列问题:

i S2的结构式为______,该反应的△H_____0(填“>”、“<”或“=”);
ii 计算 985 ℃时H2S按上述反应分解的平衡常数K=________;
iii 比较H2S的速率大小:v(a-逆)______v(b-正) ,v(b-逆)______v(c-正) (填“>”、“<”或“=”);
iiii 说明随温度的升高,曲线b向曲线a逼近的原因:___________;
②电化学法

i该法制氢过程如图2。反应池中反应物的流向采用气、液逆流方式,其目的是____________;
ii反应池中发生反应的化学方程式为___________;
iii反应后的溶液进入电解池,电解总反应的离子方程式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com