
【题目】设NA 代表阿伏加德罗常数的数值,下列说法正确的是( )
A. 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA
B. 标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA
C. 标准状况下,NA个SO3分子所占的体积约为22.4 L
D. 将0.1mol氯化铁溶于水配成1L溶液,所得溶液含有0.1NA Fe3+
【答案】B
【解析】
A、根据![]() 计算物质的量,结合一氧化氮和氧气反应生成二氧化氮,二氧化氮聚合生成四氧化二氮分析,标准状况下,44.8LNO为2mol与22.4LO2物质的量为1mol混合后反应生成2mol二氧化氮,二氧化氮聚合为四氧化二氮,气体中分子总数小于2NA,故A错误;
计算物质的量,结合一氧化氮和氧气反应生成二氧化氮,二氧化氮聚合生成四氧化二氮分析,标准状况下,44.8LNO为2mol与22.4LO2物质的量为1mol混合后反应生成2mol二氧化氮,二氧化氮聚合为四氧化二氮,气体中分子总数小于2NA,故A错误;
B、根据![]() 计算物质的量,氯气和氢氧化钠溶液反应,氯元素0价变化为+1价和-1价,标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA,故B正确;
计算物质的量,氯气和氢氧化钠溶液反应,氯元素0价变化为+1价和-1价,标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA,故B正确;
C、标准状况三氧化硫不是气体, NA个SO3分子物质的量为1mol,但所占的体积不是22.4L,故C错误;
D、铁离子水解,将0.1mol氯化铁溶于水配成1L溶液,所得溶液含有Fe3+小于0.1NA,故D错误;
综上所述,本题的正确答案为B。


科目:高中化学 来源: 题型:
【题目】如图是NaCl、MgSO4的溶解度曲线。下列说法正确的是 ( )
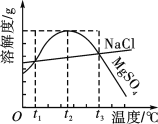
A. 只有在t1 ℃时,NaCl和MgSO4的溶解度才相等
B. t1~t2 ℃,MgSO4的溶解度随温度升高而减小
C. 在t2 ℃时,MgSO4饱和溶液的溶质质量分数最大
D. 把MgSO4饱和溶液的温度从t3 ℃降至t2 ℃时,有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料与化学密切相关,表中对应关系错误的是
材料 | 主要化学成分 | |
A | 刚玉、金刚石 | 三氧化二铝 |
B | 大理石、石灰石 | 碳酸钙 |
C | 普通水泥、普通玻璃 | 硅酸盐 |
D | 沙子、石英 | 二氧化硅 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于生物体内水和无机盐的叙述,正确的是( )
A.构成细胞的主要化合物是有机物,水和无机盐在细胞中并不重要
B.无机盐参与维持生物的 pH
C.大量元素 Fe 是构成血红蛋白的重要组成成分
D.自由水与结合水的比例恒定不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含Fe3+而可能含Fe2+,进行如下实验操作时,最佳顺序是( )
①加足量氯水 ②加足量KMnO4溶液 ③加少量KSCN溶液
A.①②B.③②C.③①D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是( )
A. n(Cl2)∶n(Fe)=5∶45Cl2+4Fe![]() 2FeCl2+2FeCl3
2FeCl2+2FeCl3
B. n(Cl2)∶n(FeBr2)=1∶1Fe2++2Br-+Cl2=Fe3++Br2+2Cl-
C. n(MnO4—)∶n(H2O2)=2∶32MnO4—+3H2O2+6H+=2Mn2++4O2↑+6H2O
D. n(Fe)∶n[HNO3(稀)]=1∶34Fe+12H++3NO3—=3Fe2++Fe3++3NO↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g);在1000℃时,平衡常数为4.0;在1300℃时,平衡常数为3.5。下列说法中,正确的是( )
Fe(s)+CO2(g);在1000℃时,平衡常数为4.0;在1300℃时,平衡常数为3.5。下列说法中,正确的是( )
A. 平衡常数的表达式为:K=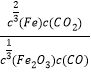
B. 在1000℃时,10L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1mol,10min达到平衡,υ(CO2)=0.006mol/(L·min)
C. 一段时间以后,铁的量不再变化,不能说明该反应达到平衡
D. 下图表示不同温度下,CO的转化率与时间关系图像
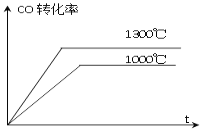
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com