
【题目】氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在周期表中的位置_____,![]() Mc 的中子数为_____。已知存在P(S,红磷)、P(S,黑磷) 、P(S,白磷),它们互称为_____。
Mc 的中子数为_____。已知存在P(S,红磷)、P(S,黑磷) 、P(S,白磷),它们互称为_____。
(2)热稳定性:NH3_____PH3(填“>”或“<”),砷的最高价氧化物对应水化物的化学式为_____是一种_____酸(填“强”或“弱”) 。
(3)PH3 和卤化氢反应与 NH3 相似,产物的结构和性质也相似。写出 PH3 和 HI 反应的化学方程式_____。
(4)SbCl3 能发生较强烈的水解,生成难溶的 SbOCl,写出该反应的化学方程式_____,因此,配制 SbCl3溶液时应注意_________。
【答案】第四周期第 VA族 173 同素异形体 > H3AsO4 弱 PH3 + HI = PH4I SbCl3 +H2O![]() SbOCl↓ + 2HCl 用较浓的盐酸而不是蒸馏水来溶解固体 SbCl3,使用前才稀释到相应的浓度
SbOCl↓ + 2HCl 用较浓的盐酸而不是蒸馏水来溶解固体 SbCl3,使用前才稀释到相应的浓度
【解析】
(1)中子数=质量数-质子数;同种元素组成的不同单质互为同素异形体;
(2)元素的非金属性越强,气态氢化物越稳定,最高价含氧酸的酸性越强;
(3)根据NH3 与HCl反应的方程式书写PH3 和 HI 反应的化学方程式;
(4)SbCl3 能发生较强烈的水解,生成难溶的 SbOCl和盐酸;
(1)砷在周期表中的位置是第四周期第 VA族,![]() Mc 的中子数为288-115=173; P(S,红磷)、P(S,黑磷) 、P(S,白磷),都是P元素组成的不同单质,它们互称为同素异形体;
Mc 的中子数为288-115=173; P(S,红磷)、P(S,黑磷) 、P(S,白磷),都是P元素组成的不同单质,它们互称为同素异形体;
(2)同主族元素从上到下非金属性减弱,非金属性N>P>As,热稳定性:NH3>PH3,砷的最高价氧化物对应水化物的化学式为H3AsO4,酸性H3PO4>H3AsO4,所以H3AsO4是弱酸;
(3)根据NH3 与HCl反应的方程式,可知PH3 和 HI 反应的化学方程式是PH3 + HI = PH4I;
(4)SbCl3 能发生较强烈的水解,生成难溶的 SbOCl和盐酸,反应方程式是SbCl3 +H2O![]() SbOCl↓ + 2HCl;增大盐酸浓度,水解平衡可逆向移动,抑制SbCl3水解,配制 SbCl3溶液时应注意用较浓的盐酸而不是蒸馏水来溶解固体 SbCl3,使用前才稀释到相应的浓度。
SbOCl↓ + 2HCl;增大盐酸浓度,水解平衡可逆向移动,抑制SbCl3水解,配制 SbCl3溶液时应注意用较浓的盐酸而不是蒸馏水来溶解固体 SbCl3,使用前才稀释到相应的浓度。


科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的常见化合价与原子序数的关系图:

(1)元素A在周期表中的位置__________________________。
(2)用电子式表示D2G的形成过程____________________________,其所含化学键类型为___________。
(3)C2-、D+、G2-离子半径由大到小顺序是____________________(用离子符号回答)。
(4)某同学设计实验证明A、B、F的非金属性强弱关系。
①溶液a和b分别为______________,________________。
②溶液c中的离子方程式为________________________________________。

(5)将0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中:
①转移电子的物质的量为_____________________________________。
②用一个离子方程式表示该反应__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1 mol·L-1NaOH溶液分别滴定20.00mL 0.1 mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是

A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积相等
C.V(NaOH)=10.00mL时,醋酸溶液中c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
D.V(NaOH)=20.00mL时,两溶液中c(CH3COO-)> c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、M、Q、R 皆为前 20 号元素,其原子半径于主要化合价的关系如图所示。说法错误的是

A.Q 位于第三周期 IA 族
B.X、Y、Z 三种元素组成的化合物可能是盐或碱
C.简单离子半径:M -﹥Q+﹥R2+
D.Z 与 M 的最高价氧化物对应水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O,测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是
NH4HCO3+NH3·H2O,测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是
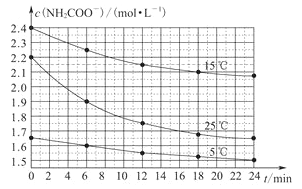
A.0~12min,初始浓度越大的实验,水解反应速率越大
B.c(NH2COO-)将随反应时间的不断延长而不断减小
C.25℃时,0~6min,v(NH2COO-)为0.05mol·L-1·min-1
D.15℃时,第30min,c(NH2COO-)为2.0mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酰胺(H2C=CH—CONH2)具有中等毒性,它对人体可造成神经毒性和遗传毒性。丙烯酰胺主要是由高碳水化合物、低蛋白质的植物性食物在加热(120℃以上)烹调过程中形成,特别在烘烤、油炸时更易形成。丙烯酰胺可以进一步形成在工业上有用的聚丙烯酰胺类物质。

回答下列问题:
(1)D的结构简式为___,F的结构简式为___。
(2)指明下列反应类型:A→B___,C→D___。
(3)丙烯酰胺有多种同分异构体,写出分子中同时含有醛基和碳碳双键的同分异构体:___。
(4)写出D→E的化学方程式:__。2分子C在浓硫酸作用下可形成一个六元酯环,该反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() ,发生反应:
,发生反应:![]() 经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
| 0 | 2 | 4 | 6 | 8 |
| 0 |
|
|
|
|
下列说法正确的是![]()
A.反应在前2s的平均速率![]()
B.保持其他条件不变,体积压缩到![]() ,平衡常数将增大
,平衡常数将增大
C.相同温度下,起始时向容器中充入![]() ,达到平衡时,
,达到平衡时,![]() 的转化率等于
的转化率等于![]()
D.保持温度不变,向该容器中再充入![]() 、
、![]() ,反应达到新平衡时
,反应达到新平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
B.1L、0.1mol/L的Na2CO3溶液中含阴离子总数为0.1NA个
C.标准状况下,22.4LHF含NA个分子
D.标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图。下列有关说法中正确的是( )

A.y轴表示的可能是电离能B.y轴表示的可能是电负性
C.y轴表示的可能是原子半径D.y轴表示的可能是形成基态离子转移的电子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com