
【题目】金属镓(Ga)应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。
(1)铝在元素周期表中的位置是_________。
(2)GaAs 是一种重要的半导体材料。As 与 Ga 同周期,As 与 N 同主族。
①下列事实不能用元素周期律解释的是___________(填字母)。
a. 碱性:Ga (OH)3> Al (OH)3 b. 非金属性:As>Ga c. 酸性:H3AsO4>H3AsO3
②GaAs 中,As 元素化合价为-3 价,用原子结构理论解释原因_________________。
③废弃含 GaAs 半导体材料可以用浓硝酸溶解 GaAs,生成 H3AsO4 和 Ga3+,写出该反应的化学方程式_________。
(3)工业上获取镓的方法之一是从闪锌矿冶锌后的残渣(主要含有 Zn、Pb、Fe、Ga 等元素)中提取,某科研单位设计下述流程提取镓,已知:Ga 在碱性溶液中以[Ga(OH)4]- 形式存在。

①试剂 a 是_____。
②写出得到滤液 3 的离子方程式_______________。
③写出电解制镓时的阴极电极反应式__________________。
【答案】第三周期第 IIIA 族 c Ga 与As 电子层数相同,核电荷数:As > Ga,原子半径:As < Ga,得电子能力:As > Ga,元素的非金属性:As > Ga,因此,GaAs 中 As 为负价;As 与N 同主族,最外层 5 个电子,最低负化合价为-3 GaAs+HNO3(浓) =Ga(NO3)3+8NO2↑+H3AsO4+4H2O ZnO Ga(OH)3+OH- = [Ga(OH)4]- [Ga(OH)4]- +3e- = Ga+ 4OH-
【解析】
(1)铝是13号元素,铝在元素周期表中的位置是第三周期第 IIIA 族。故答案为:第三周期第 IIIA 族;
(2)①a. 同周期,从左到右元素的金属逐渐减弱,碱性:Ga (OH)3> Al (OH)3,故不选;
b. 同周期,从左到右元素非金属逐渐增强,非金属性:As>Ga,故不选;
c. 非羟基氧越多,含氧酸的酸性越强,酸性:H3AsO4>H3AsO3,故选;
故答案为:c;
②GaAs 中,As 元素化合价为-3 价,用原子结构理论解释原因:Ga 与As 电子层数相同,核电荷数:As > Ga,原子半径:As < Ga,得电子能力:As > Ga,元素的非金属性:As > Ga,因此,GaAs 中 As 为负价;As 与N 同主族,最外层 5 个电子,最低负化合价为-3。故答案为:Ga 与As 电子层数相同,核电荷数:As > Ga,原子半径:As < Ga,得电子能力:As > Ga,元素的非金属性:As > Ga,因此,GaAs 中 As 为负价;As 与N 同主族,最外层 5 个电子,最低负化合价为-3;
③废弃含 GaAs 半导体材料可以用浓硝酸溶解 GaAs,生成 H3AsO4 和 Ga3+,硝酸被还原成NO2,反应的化学方程式GaAs+HNO3(浓) = Ga(NO3)3+8NO2↑+H3AsO4+4H2O。故答案为:GaAs+HNO3(浓) = Ga(NO3)3+8NO2↑+H3AsO4+4H2O;
(3)闪锌矿冶锌后的残渣(主要含有 Zn、Pb、Fe、Ga 等元素)酸浸后得到:滤渣1中含PbSO4,滤液1中含有 Zn2+、Fe2+、Ga3+,加ZnO调节pH =9,得滤渣2,主要成分为Fe(OH)3、Ga(OH)3,加入浓NaOH溶液,发生Ga(OH)3+OH- = [Ga(OH)4]-,过滤得滤渣3为Fe(OH)3、滤液3,电解制镓。
①试剂 a 是ZnO。故答案为:ZnO;
②由题中信息:Ga 在碱性溶液中以[Ga(OH)4]- 形式存在,得到滤液 3 的离子方程式Ga(OH)3+OH- = [Ga(OH)4]-。故答案为:Ga(OH)3+OH- = [Ga(OH)4]-;
③电解制镓时的阴极得电子,发生还原反应,电极反应式[Ga(OH)4]- +3e- = Ga+ 4OH-。故答案为:[Ga(OH)4]- +3e- = Ga+ 4OH-。


科目:高中化学 来源: 题型:
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如下:
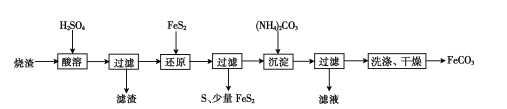
已知:“还原”时,FeS2与H2SO4不反应。
(l)“酸溶”时Fe2O3发生的化学反应方程式为________
(2)实验室“过滤”时所用的玻璃仪器有烧杯、________
(3)“还原”时生成S的离子方程式为________
(4)检验FeCO3是否洗净的方法是________
(5)“滤液”中的溶质可能有____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某恒温密闭容器中,投入一定量的A发生可逆反应:A(s)![]() B(g)+C(g) △H=-QkJ·mol-1(Q>0)。一段时间后反应达到平衡,然后缩小容器体积,重新达到平衡。下列分析不正确的是
B(g)+C(g) △H=-QkJ·mol-1(Q>0)。一段时间后反应达到平衡,然后缩小容器体积,重新达到平衡。下列分析不正确的是
A. 两次平衡时,C(g)的浓度相等
B. 平衡时,单位时间内:n(B)生成:n(C)消耗=1:1
C. 若开始时向容器中加入1 mol B和1 mol C,则达到平衡时吸收Q kJ热量
D. 若再向平衡体系中加入少量A,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行了探究。己知在不同温度下的化学平衡常数(K1、K2、K3)如表所示。
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g)CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) | △H3 | K3 | |||
请回答下列问题:
(1)反应②是_______(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示);根据反应③判断△S_______(填“>”“=”或“<”)0,在_______(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有______(填字母,后同)。
A.缩小反应容器的容积 B.增大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.从平衡体系中及时分离出CH3OH
(4)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g的浓度分别为 0.1mol/L、0.8 mol/L、0.3 mol/L、0.15 mol/L,则此时v(正)_______v(逆) (填“>”“=”或“<”)。
(5)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升高温度,t1时平衡,t2时减小压强,t3时增大CO的浓度,t4时又达到平衡。在下图中画出t2至t4的曲线。_____

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2排放至空气中会造成大气污染,某研究小组利用软锰矿(主要成分为MnO2,另含少量铁,铝,铜,镍等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
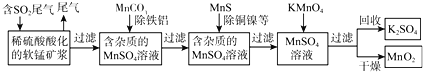
请回答下列问题:
(1)已知:25℃、101kPa时,
Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
S(s)+O2(g)=SO2(g) △H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
根据以上信息写出用MnO2脱硫的热化学方程式是______
(2)第二步加入MnCO3其原因是______
(3)若最后一步所加KMnO4恰好反应完全,如何证明过滤所得的MnO2固体已洗涤干净:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含硫酸铵和硝酸铵的混合液aL分成两等份。一份加入bmolNaOH并加热,恰好把NH3全部赶出;另一份需消耗cmol BaCl2沉淀反应恰好完全,则原溶液中NO3- 的浓度为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 向400mL某浓度的稀硝酸中加入Wg铁粉(还原产物只有NO),充分反应后,铁粉减少16.8 g且铁粉有剩余,继续向容器中加入足量的稀硫酸,会产生气体A。回答下列问题:
(1)稀硝酸的物质的量浓度是_____________ mol·L1
(2)气体A中若含有H2,则W的值一定要大于__________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各有机物同分异构体数目的判断中不正确的是
A | B | C | D | |
分子式 | C6H14 | C4H8Cl2 | C4H9Cl | C3H6 |
数目 | 5 | 8 | 4 | 2 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com