
【题目】 向400mL某浓度的稀硝酸中加入Wg铁粉(还原产物只有NO),充分反应后,铁粉减少16.8 g且铁粉有剩余,继续向容器中加入足量的稀硫酸,会产生气体A。回答下列问题:
(1)稀硝酸的物质的量浓度是_____________ mol·L1
(2)气体A中若含有H2,则W的值一定要大于__________g.
【答案】2 67.2
【解析】
过量铁与稀硝酸反应方程式是3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;继续向容器中加入足量的稀硫酸依次发生的反应是3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O、Fe+2H+= Fe2++H2↑。
(1)过量铁与稀硝酸反应方程式是3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;16.8 g铁粉的物质的量是![]() ,根据反应方程式,消耗硝酸的物质的量是0.8mol;铁粉有剩余,说明硝酸完全反应,所以硝酸的浓度是
,根据反应方程式,消耗硝酸的物质的量是0.8mol;铁粉有剩余,说明硝酸完全反应,所以硝酸的浓度是![]() 2 mol·L1;
2 mol·L1;
(2)加入硫酸前,溶液中的溶质是0.3mol Fe(NO3)2,则含有0.6mol NO3-;继续向容器中加入足量的稀硫酸,会产生气体A,气体A中若含有H2,依次发生的反应是3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O、Fe+2H+= Fe2++H2↑,根据0.6mol硝酸根离子,完成3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O反应,消耗铁粉的物质的量是0.9mol,所以 W的值一定要大于16.8g+0.9mol×56g/mol=67.2g。


科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g)![]() 2C(g)达到平衡状态标志的是( )
2C(g)达到平衡状态标志的是( )
①C生成的速率与C分解的速率相等;②单位时间内生成a mol A,同时生成3a mol B;③A、B、C的浓度不再变化;④A、B、C的压强不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦单位时间内消耗a mol A,同时生成3a mol B;⑧A、B、C的分子数之比为1∶3∶2
A.②⑧B.①⑥C.②④D.③⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体,这些气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入6molL﹣1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mLB.45 mLC.30 mLD.50 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 溶液中滴加少量
溶液中滴加少量![]() 溶液,反应原理如图所示。关于该反应过程的说法正确的是
溶液,反应原理如图所示。关于该反应过程的说法正确的是

A.该反应过程中,![]() 是
是![]() 是
是![]() B.当有
B.当有![]() 生成时,转移
生成时,转移![]() 电子
电子
C.在![]() 分解过程中,溶液的
分解过程中,溶液的![]() 逐渐降低D.
逐渐降低D.![]() 的氧化性比
的氧化性比![]() 强,还原性比
强,还原性比![]() 弱
弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用NaOH标准溶液滴定未知浓度的盐酸,进行了如下实验:取15 mL待测溶液于250 mL锥形瓶中,加入1~2滴酚酞试液,用NaOH标准溶液滴定。按上述操作方法再重复2次。
(1)填空:(①、②小题中选填“偏高”、“偏低”或“无影响”)
①装碱滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则待测液的浓度________;
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________;
③滴定时边滴边摇动锥形瓶,眼睛应观察________________________;
④滴定达到终点时,酚酞指示剂由________色变成________色。
(2)滴定结果如下表所示:
滴定次数 | 标准溶液的体积/mL | 待测盐酸溶液的体积/ mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 1.05 | 21.10 | 15.00 |
2 | 2.00 | 21.95 | 15.00 |
若NaOH标准溶液的浓度为0.1010 mol/L,则待测液的浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据 A-I 在周期表中的位置,用元素符号或化学式回答下列问题。
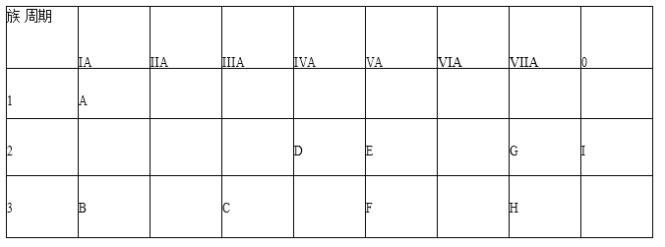
(1)表中元素,化学性质最不活泼的是_____,只有负价而无正价的是_____,氧化性最强的单质是____;
(2)最高价氧化物的水化物碱性最强的是_____,酸性最强的是_____,呈两性的是_____;
(3)A 分别与 D、E、F、G、H 形成的化合物中,最稳定的是_____;
(4)在 B、C、D、E、F、G、H 中,原子半径最大的是_____;
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外 M 电子层与 K 电子层上的电子数相等,甲、乙两元素相比较,金属性较强的是_______可以验证该结论的实验是_。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用碳酸钙的分解产物与足量焦炭在高温电炉中生成电石。
(1)写出该反应的方程式:_____。
(2)电石的保存需严格防水,写出电石与水反应的化学方程式:_____。
(3)写出上述反应方程式中非极性分子的结构式:_____。
(4)写出电石的电子式_____。
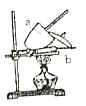
(5)实验室用右图制取乙炔并验证乙炔与溴水发生了加成反应。

①实验中控制反应速率的措施有_____、_____。
②小试管中可能的现象是:溴水褪色、_____。
③溴水褪色_____(“能” “不能”)证明乙炔与溴发生了加成反应,若能,说明理由,若不能, 写出修改方案_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组设计以下实验方案,测定某含有NaCl的小苏打样品中![]() 的质量分数。
的质量分数。
(方案一)查资料:NaCl加热至![]() 时熔化而不分解,
时熔化而不分解,![]() 受热分解,
受热分解,![]() 。由此设计实验:用电子天平称取
。由此设计实验:用电子天平称取![]() 样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于
样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于![]() ,不超过
,不超过![]() ),至恒重后,冷却,称量剩余固体质量为
),至恒重后,冷却,称量剩余固体质量为![]() 。
。
(1)实验中至少称量____次。
(2)实验中,达到恒重操作的标准是__________。
(方案二)根据“![]() 溶液呈碱性,
溶液呈碱性,![]() ”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
1 | 2 | |
| 20.00 | 20.00 |
| 0.00 | 0.20 |
| 19.98 | 20.22 |
(3)实验中,当其它操作均正确时,下列操作不会引起实验误差的是(______)。
A.容量瓶用蒸馏水洗净后,瓶内有水残留,直接配制溶液
B.滴定管内壁有水珠就装入标准液
C.锥形瓶内壁有水珠,用待测液润洗后再使用
D.锥形瓶用蒸馏水洗净后,直接放入待测液进行测定
span>(4)滴定终点的判断:__________。
(5)两次实验消耗盐酸体积的平均值为__________mL。
(6)样品中![]() 的质量分数__________。
的质量分数__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com