
【题目】某化学学习小组设计以下实验方案,测定某含有NaCl的小苏打样品中![]() 的质量分数。
的质量分数。
(方案一)查资料:NaCl加热至![]() 时熔化而不分解,
时熔化而不分解,![]() 受热分解,
受热分解,![]() 。由此设计实验:用电子天平称取
。由此设计实验:用电子天平称取![]() 样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于
样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于![]() ,不超过
,不超过![]() ),至恒重后,冷却,称量剩余固体质量为
),至恒重后,冷却,称量剩余固体质量为![]() 。
。
(1)实验中至少称量____次。
(2)实验中,达到恒重操作的标准是__________。
(方案二)根据“![]() 溶液呈碱性,
溶液呈碱性,![]() ”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
1 | 2 | |
| 20.00 | 20.00 |
| 0.00 | 0.20 |
| 19.98 | 20.22 |
(3)实验中,当其它操作均正确时,下列操作不会引起实验误差的是(______)。
A.容量瓶用蒸馏水洗净后,瓶内有水残留,直接配制溶液
B.滴定管内壁有水珠就装入标准液
C.锥形瓶内壁有水珠,用待测液润洗后再使用
D.锥形瓶用蒸馏水洗净后,直接放入待测液进行测定
span>(4)滴定终点的判断:__________。
(5)两次实验消耗盐酸体积的平均值为__________mL。
(6)样品中![]() 的质量分数__________。
的质量分数__________。
【答案】3 两次称量的质量差不大于0.001g AD 溶液由黄色变为橙色,并在半分钟内不变色 20.00mL 84%
【解析】
(1)在进行热分解实验后固体质量分析时,为确保固体分解完全,减少操作误差,对冷却后固体的质量至少称量3次。答案为:3
(2)依据样品的质量1.000 g分析,该电子天平的精度为0.001g,所以,实验中达到恒重操作的标准是两次称量的质量差不大于0.001g。答案为:两次称量的质量差不大于0.001g。
(3)A.容量瓶用蒸馏水洗净后,瓶内有水残留,直接配制溶液,不改变溶质的物质的量,不产生误差;
B.滴定管内壁有水珠就装入标准液,标准液浓度减小,滴定时所用体积增大,但计算时仍用标准液的浓度进行计算,从而使所测待测液的浓度偏大,结果偏高;
C.锥形瓶内壁有水珠,用待测液润洗后再使用,锥形瓶内待测液的物质的量增大,所用标准液的体积增大,所测待测液的浓度偏高;
D.锥形瓶用蒸馏水洗净后,直接放入待测液进行测定,不产生误差。
答案为AD。
(4)起初锥形瓶内加入的是碳酸氢钠溶液,滴加甲基橙呈黄色,滴定达终点时,溶液由黄色逐渐变为橙色,并在半分钟内不变色。答案为:溶液由黄色变为橙色,并在半分钟内不变色
(5)第一次实验消耗盐酸20.02mL,第二次实验消耗盐酸19.98mL,两次实验消耗盐酸体积的平均值为20.00mL。答案为:20.00mL
(6)样品中![]() 的质量分数
的质量分数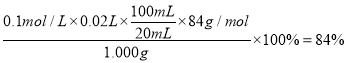
答案为84%


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】 向400mL某浓度的稀硝酸中加入Wg铁粉(还原产物只有NO),充分反应后,铁粉减少16.8 g且铁粉有剩余,继续向容器中加入足量的稀硫酸,会产生气体A。回答下列问题:
(1)稀硝酸的物质的量浓度是_____________ mol·L1
(2)气体A中若含有H2,则W的值一定要大于__________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是
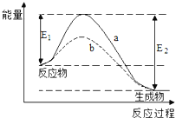
A. 该反应为吸热反应
B. a与b相比,a的反应速率更快
C. a与b相比,反应的平衡常数一定不同
D. 反应物吸收的总能量小于生成物释放的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,将前者和后者混合时,无论前者是否过量,都能用同一个化学方程式表示的是( )
A.![]() 溶液,NaOH溶液B.稀
溶液,NaOH溶液B.稀![]() ,
,![]() 溶液
溶液
C.澄清石灰水,![]() D.氨水,
D.氨水,![]() 溶液
溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是非常重要的有机物,它的产量通常用来衡量一个国家石油化工发展水平。请回答下列问题:
(1)工业上以乙烯为原料可合成一重要有机高分子化合物,该材料可用于食品包装。合成该物质的化学方程式为________,反应类型是_____。
(2)为探究实验室制乙烯及乙烯和溴水的反应,甲同学设计了如图所示的实验装置。制备乙烯的化学方程式:________;乙烯使溴水褪色的化学方程式:__________,反应类型_____。
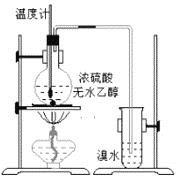
(3)写出下列物质所对应的同分异构体的结构简式:
①![]() 的同分异构体的结构简式____________________。
的同分异构体的结构简式____________________。
②![]() 的同分异构体的结构简式____________________。
的同分异构体的结构简式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.12g铁粉加入25mL 2molL﹣1的氯化铁溶液中,充分反应后,其结果是( )
A. 铁有剩余,溶液呈浅绿色,Cl﹣浓度基本不变
B. 往溶液中滴入无色KSCN溶液,显黄色
C. Fe2+和Fe3+的物质的量之比为6:1
D. 氧化产物与还原产物的物质的量之比为2:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是反应CO(g) +2H2(g) ![]() CH3OH (g)过程中的能量变化如下图所示,曲线a和b分别表示不使用催化剂和使用催化剂的两种情况。下列相关说法正确的是( )
CH3OH (g)过程中的能量变化如下图所示,曲线a和b分别表示不使用催化剂和使用催化剂的两种情况。下列相关说法正确的是( )
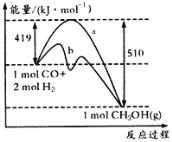
A.加入催化剂,该反应的△H变小
B.如果该反应生成液态CH3OH,则△H变大
C.该反应的△H=+91 kJ/moL
D.反应物的总能量大于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
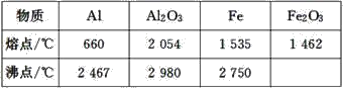
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理_(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是__,反应的离子方程式为_。
(3)实验室溶解该熔融物,下列试剂中最好的是__(填序号),并说明理由:__。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com