
【题目】如图是反应CO(g) +2H2(g) ![]() CH3OH (g)过程中的能量变化如下图所示,曲线a和b分别表示不使用催化剂和使用催化剂的两种情况。下列相关说法正确的是( )
CH3OH (g)过程中的能量变化如下图所示,曲线a和b分别表示不使用催化剂和使用催化剂的两种情况。下列相关说法正确的是( )
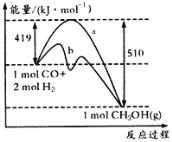
A.加入催化剂,该反应的△H变小
B.如果该反应生成液态CH3OH,则△H变大
C.该反应的△H=+91 kJ/moL
D.反应物的总能量大于生成物的总能量
科目:高中化学 来源: 题型:
【题目】根据 A-I 在周期表中的位置,用元素符号或化学式回答下列问题。
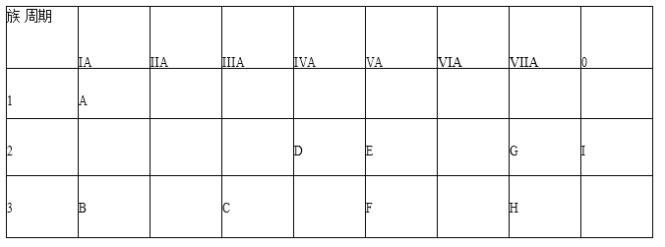
(1)表中元素,化学性质最不活泼的是_____,只有负价而无正价的是_____,氧化性最强的单质是____;
(2)最高价氧化物的水化物碱性最强的是_____,酸性最强的是_____,呈两性的是_____;
(3)A 分别与 D、E、F、G、H 形成的化合物中,最稳定的是_____;
(4)在 B、C、D、E、F、G、H 中,原子半径最大的是_____;
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外 M 电子层与 K 电子层上的电子数相等,甲、乙两元素相比较,金属性较强的是_______可以验证该结论的实验是_。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行如下实验,研究化学反应中的热量变化。
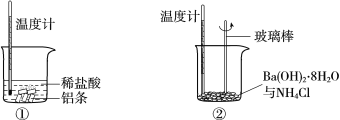
请回答下列问题:
(1)反应后①中温度升高,②中温度降低。由此判断铝条与盐酸的反应是________反应(填“放热”或“吸热”,下同),Ba(OH)2·8H2O与NH4Cl的反应是________反应。
(2)①中反应的离子方程式是_________,该反应的还原剂是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组设计以下实验方案,测定某含有NaCl的小苏打样品中![]() 的质量分数。
的质量分数。
(方案一)查资料:NaCl加热至![]() 时熔化而不分解,
时熔化而不分解,![]() 受热分解,
受热分解,![]() 。由此设计实验:用电子天平称取
。由此设计实验:用电子天平称取![]() 样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于
样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于![]() ,不超过
,不超过![]() ),至恒重后,冷却,称量剩余固体质量为
),至恒重后,冷却,称量剩余固体质量为![]() 。
。
(1)实验中至少称量____次。
(2)实验中,达到恒重操作的标准是__________。
(方案二)根据“![]() 溶液呈碱性,
溶液呈碱性,![]() ”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
1 | 2 | |
| 20.00 | 20.00 |
| 0.00 | 0.20 |
| 19.98 | 20.22 |
(3)实验中,当其它操作均正确时,下列操作不会引起实验误差的是(______)。
A.容量瓶用蒸馏水洗净后,瓶内有水残留,直接配制溶液
B.滴定管内壁有水珠就装入标准液
C.锥形瓶内壁有水珠,用待测液润洗后再使用
D.锥形瓶用蒸馏水洗净后,直接放入待测液进行测定
span>(4)滴定终点的判断:__________。
(5)两次实验消耗盐酸体积的平均值为__________mL。
(6)样品中![]() 的质量分数__________。
的质量分数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A 的分子式为C3H6O2,它与氢氧化钠溶液共热蒸馏得到含B的蒸馏产物。将B与浓硫酸混合加热,控制温度可以得到一种能使溴的四氯化碳溶液褪色,并可做果实催熟剂的气体C。B在一定温度和催化剂存在下,能被空气氧化为D,D与新制的Cu(OH)2悬浊液加热,有红色沉淀E产生。请回答下列问题:
(1)写出下列物质的结构简式:A________; B________;D__________;
(2)写出化学方程式:B→C:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为____________,S、O、N三种元素的第一电离能由大到小为____________。
(2)SO42-的立体构型是________,与SO42-互为等电子体的一种分子为____________(填化学式)。
(3)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NO3-中心原子的杂化轨道类型为________,[Cu(NH3)4](NO3)2中存在的化学键类型除了极性共价键外,还有____________。
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是____________。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(![]() ,
,![]() ,
,![]() )。则D原子的坐标参数为________,它代表________原子。
)。则D原子的坐标参数为________,它代表________原子。
②若Cu2O晶体密度为d g·cm-3,晶胞参数为a pm,则阿伏加德罗常数值NA=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,下列关于溶液中的量的关系判断正确的是
A. H+浓度:10c(H+)甲=c(H+)乙 B. OH-浓度:c(OH-)甲=10c(OH-)乙
C. 溶液浓度:c(甲)>10c(乙) D. 与等量NaOH反应耗酸体积:10V(甲)>V(乙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+由H、C、N三种元素组成,结构如下图所示。回答下列问题:

(1)碳原子价层电子的轨道表达式为______,基态碳原子中,核外电子占据的最高能级的电子云轮廓图为______形。
(2)根据价层电子对互斥理论,NH3、![]() 、
、![]() 中,中心原子价层电子对数不同于其他两种粒子的是_______。NH3比PH3的沸点高,原因是____________。
中,中心原子价层电子对数不同于其他两种粒子的是_______。NH3比PH3的沸点高,原因是____________。
(3)氮元素的第一电离能比同周期相邻元素都大的原因是____________。
(4)EMIM+中,碳原子的杂化轨道类型为________。分子中的大π键可用符号![]() 表示,其中n代表参与形成的大π键原子数,m代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中n代表参与形成的大π键原子数,m代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则EMIM+中的大π键应表示为________。
),则EMIM+中的大π键应表示为________。
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如下图所示。立方氮化硼属于______晶体,其中硼原子的配位数为_____。已知:立方氮化硼密度为d g/cm3,B原子半径为x pm,N原子半径为y pm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为_______(列出化简后的计算式)。
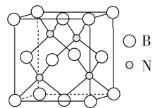
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O,下列说法正确的是
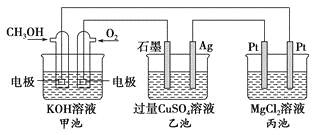
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com