
【题目】根据 A-I 在周期表中的位置,用元素符号或化学式回答下列问题。
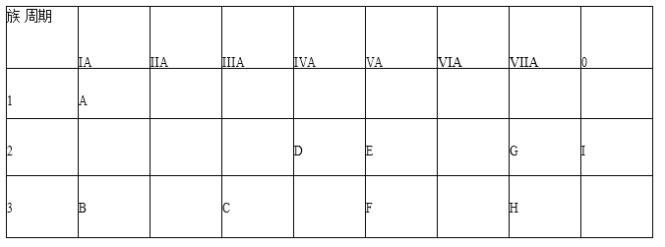
(1)表中元素,化学性质最不活泼的是_____,只有负价而无正价的是_____,氧化性最强的单质是____;
(2)最高价氧化物的水化物碱性最强的是_____,酸性最强的是_____,呈两性的是_____;
(3)A 分别与 D、E、F、G、H 形成的化合物中,最稳定的是_____;
(4)在 B、C、D、E、F、G、H 中,原子半径最大的是_____;
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外 M 电子层与 K 电子层上的电子数相等,甲、乙两元素相比较,金属性较强的是_______可以验证该结论的实验是_。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
【答案】Ne F F2 NaOH HClO4 Al(OH)3 HF Na 镁 bc
【解析】
对照元素周期表,各元素分别为:A-H、B-Na、C-Al、D-C、E-N、F-P、G-F、H-Cl、I-Ne。
(1)根据元素的性质回答;
(2)同周期各元素最高价氧化物对应水化物的酸碱性回答;
(3)元素的非金属性越强,氢化物稳定性越强;
(4)周期表中从上至下,从右至左,原子半径增大;
(5)甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,则甲为Al,乙元素原子核外M电子层与K电子层上的电子数相等,则乙为Mg;
同周期自左而右元素金属性减弱,可以根据金属与水的反应难易、剧烈程度或金属和酸反应置换出氢气的难易或是最高价氧化物对应水化物的碱性强弱或金属单质之间的置换反应等来判断.
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的单质是F2;
(2)同周期各元素最高价氧化物对应水化物的碱性减弱,酸性增强,最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3;
(3)元素的非金属性越强,氢化物稳定性越强,A 分别与 D、E、F、G、H 形成的化合物中,最稳定的是HF;
(4)周期表中从上至下,从右至左,原子半径增大,在 B、C、D、E、F、G、H 中,原子半径最大的是Na;
(5)甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,则甲为Al,乙元素原子核外M电子层与K电子层上的电子数相等,则乙为Mg;甲、乙两元素相比较,金属性较强的是Mg可以验证该结论的实验是:
(a) 金属在在空气中放置已久,表面生成氧化物保护膜,阻止金属与水反应,不能比较金属性强弱,故错误;
(b) 将除掉表面氧化膜的这两种元素的单质分别和同浓度的盐酸反应,反应越剧烈,则元素金属性越强,故正确;
(c) 将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液,比较碱性强弱,加入Mg粉的溶液呈浅红色,而加入Al粉的无明显现象,故正确;
(d) 二者都是金属元素,不能比较氢化物的稳定性判断金属性强弱,故错误,
故选bc。


科目:高中化学 来源: 题型:
【题目】已知:5种短周期元素A、B、C、D、E的原子序数依次增大。A原子只有1个电子;元素B的最外层电子数比内层电子数多3;元素C是海水中质量分数最大的元素;D的单质可在B的单质中点燃条件下燃烧生成一种离子化合物;元素E与C形成的化合物EC2可用于自来水的消毒。请回答下列问题:
(1)在周期表中,元素B位于第_____周期____族;B与D形成的离子化合物的电子式为________。
(2)C、D形成的简单离子的半径大小关系为(用离子符号表示)________________。
(3)B、D元素形成的化合物可与水反应生成一种沉淀和一种气体,试写出反应的化学方程式:________________________________________________________________。
(4)A、B形成的化合物可与B、C形成的化合物在一定条件下反应生成一种无毒、参与大气循环的气体,试写出其中的一个化学方程式:______________________________。
(5)写出E的单质与水反应的离子方程式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的数值为NA。下列说法正确的是
A. 1 L 1 mol·L-1的NaHSO3溶液中含有的离子数为3NA
B. 5.6g乙烯和环丙烷的混合物中含C—H键数目为0.8NA
C. 常温常压下,22.4L的37Cl2中所含的中子数为40NA
D. 硝酸与铜反应生成0.1mol NOx时,转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)中国四大发明之一的指南针由天然磁石制成的,其主要成分是___。
A .Fe B.FeO C.Fe3O4 D.Fe2O3
(2)实验室用绿矾FeSO4·xH2O配制FeSO4溶液时为了防止FeSO4溶液变质,经常向其中加入铁粉,其原因是___(用离子方程式表示)。
(3)某同学甲取2mLFeSO4溶液,加入1滴KSCN溶液,再加入几滴氯水,溶液变红,说明Cl2可将Fe2+氧化。FeSO4溶液与氯水反应的离子方程式为___。
(4)同学乙认为甲同学的实验不够严谨,该同学在2mLFeSO4溶液中先加入0.5mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是___。
(5)为测定某绿矾FeSO4.xH2O中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。
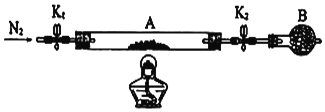
①仪器B的名称是___。
②将下列实验操作步骤正确排序___(填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾FeSO4·xH2O化学式中结晶水数目x=___(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜在常温下能被HNO3溶解。反应方程式为: 3Cu+8HNO3=3Cu(NO3)2+2NO ↑+4H2O
(1)请将上述反应改成离子方程式,并用单线桥法表示电子得失的方向和数目__________
(2)若生成448mL的NO(标准状况下),则该过程中转移的电子是___________mol。
(3)被还原的硝酸占参加反应硝酸的比例为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
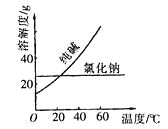
【题目】阅读、分析下列两个材料:
材料一:
材料二:
物质 | 熔点/℃ | 沸点/℃ | 密度/ | 溶解性 |
乙二醇 |
| 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题(填序号):
A. 蒸馏法 B. 萃取法 C. “溶解、结晶、过滤”的方法 D. 分液法
①将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用_________。
②将乙二醇和丙三醇相互分离的最佳方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溶液中加入新物质时, 其导电性(I)符合下图变化趋势的实验操作是
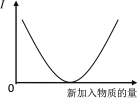
A. 乙酸溶液中通入氨气至过量
B. 石灰水中通入CO2至过量
C. 亚硫酸中通入氯气至过量
D. 氨水中通入氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度均为0.1 mol/L的下列溶液:
①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)___________________________。
(2)④、⑤、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是(填序号)________ 。
(3)将②、③混合后,若溶液呈中性,则消耗两溶液的体积为 ② ________ ③(填“>”、“<”或“=”)溶液中的离子浓度由大到小的顺序为______________________________
(4)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液,判断:
①其中有两种粒子的物质的量之和一定等于0.010 mol,它们是________和________。
②溶液中c(CH3COO-)+n(OH-)-n(H+)=________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应是重要的化工反应,请回答下列问题:
(1)①NH3(g)+![]() O2(g)
O2(g)![]() NO2(g)+
NO2(g)+![]() H2O(g) △H=-299.6kJ·mol-1
H2O(g) △H=-299.6kJ·mol-1
②H2(g)+![]() O2(g)=H2O(g) △H=-241.8kJ·mol-1
O2(g)=H2O(g) △H=-241.8kJ·mol-1
③N2(g)+2O2(g)=2NO2(g) △H=+33.9kJ·mol-1
由上述反应,可求出N2(g)+3H2(g)![]() 2NH3(g)的△H=___。
2NH3(g)的△H=___。
(2)对于反应①,在恒温恒容(H2O为气态)的容器中,下列选项表明反应已达到平衡的是___。
A.混合气体的平均摩尔质量不变
B.混合气体的密度不变
C.气体的颜色不再变化
D.体系内压强不再变化
E.每消耗1molNH3的同时生成1molNO2
(3)已知:N2(g)+3H2(g)![]() 2NH3(g)反应的熵变△S=-0.081kJ·mol-1·K-1,则298K时,该反应___(填“能”或“不能”)自发进行。
2NH3(g)反应的熵变△S=-0.081kJ·mol-1·K-1,则298K时,该反应___(填“能”或“不能”)自发进行。
(4)如图为673K温度下,某合成氨塔里各气体组分压强变化图。
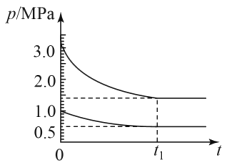
①t1平衡时,氨气的体积分数为___%(保留位小数)。
②在图中画出氨气组分压强变化图___。
③该温度下N2(g)+3H2(g)![]() 2NH3(g)反应的压力平衡常数Kp=___(MPa)-2(保留1位小数,Kp为以气体分压表示反应的平衡常数)
2NH3(g)反应的压力平衡常数Kp=___(MPa)-2(保留1位小数,Kp为以气体分压表示反应的平衡常数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com