
【题目】设阿伏加德罗常数的数值为NA。下列说法正确的是
A. 1 L 1 mol·L-1的NaHSO3溶液中含有的离子数为3NA
B. 5.6g乙烯和环丙烷的混合物中含C—H键数目为0.8NA
C. 常温常压下,22.4L的37Cl2中所含的中子数为40NA
D. 硝酸与铜反应生成0.1mol NOx时,转移电子数为0.2NA
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积可变的容器中,通入3 mol SO2和2 mol O2及固体催化剂,使之反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ·mol-1,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是( )
2SO3(g) ΔH=-196.6 kJ·mol-1,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是( )
A. 第一次平衡时反应放出的热量为294.9 kJ
B. 两次平衡SO2的转化率相等
C. 第二次达平衡时SO3的体积分数大于![]()
D. 达平衡时用O2表示的反应速率为0.25 mol·(L·min)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某杀菌药物M的合成路线如下图所示。

回答下列问题:
(1)A中官能团的名称是_______________。B→C的反应类型是__________________。
(2)B的分子式为________________________。
(3)C→D的化学方程式为__________________________。
(4)F的结构简式为___________________________。
(5)符合下列条件的C的同分异构体共有____________种(不考虑立体异构);
①能发生水解反应;②能与FeCl3溶液发生显色反应。
其中核磁共振氢谱为4组峰的结构简式为_______________(任写一种)。
(6)请以![]() 和CH3CH2OH为原料,设计制备有机化合物
和CH3CH2OH为原料,设计制备有机化合物 的合成路线(无机试剂任选)_______________。
的合成路线(无机试剂任选)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池在人类生产生活中具有十分重要的作用,其中锂离子电池与太阳能电池占有很大比重。太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料有单晶硅,还有铜、锗、镓、硒等化合物。
(1)基态亚铜离子中电子占据的原子轨道数目为____________。
(2)若基态硒原子价层电子排布式写成4s24px24py2,则其违背了____________。
(3)下图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是_______(填标号)。

(4)元素X与硅同主族且原子半径最小,X形成的最简单氢化物Q的电子式为_____,该分子其中心原子的杂化类型为_____。写出一种与Q互为等电子体的离子______。
(5)与镓元素处于同一主族的硼元素具有缺电子性。自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作Na2B4O7·10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]8H2O.其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是__________(填选项字母)。

A 离子键 B 共价键 C 金属键 D 范德华力 E 氢键
(6)GaAs的熔点为1238℃,密度为ρg·cm3,其晶胞结构如图所示。已知GaAs与GaN具有相同的晶胞结构,则二者晶体的类型均为____,GaAs的熔点____(填“高于”或“低于”)GaN。Ga和As的摩尔质量分别为MGa gmol1和MAs gmol1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.碳﹣12 原子和碳﹣13 原子的中子数相同
B.KMnO4 和 K2 MnO4 中有相同的原子团
C.Fe2+和 Fe3+都属于铁元素,核外电子数不同
D. 和
和 化学性质相似
化学性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题,回答下列问题:
(1)乙醇是未来内燃机的首选环保型液体燃料。2.0g乙醇完全燃烧生成液态水放出59.43kJ的热量,则乙醇燃烧的热化学方程式为__________________________________________________________ 。
(2)由于C3H8(g)![]() C3H6(g)+H2(g) ΔH=+bkJ·mol-1(b>0)的反应中,反应物具有的总能量________(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要________(填“放出”或“吸收”)能量才能转化为生成物。
C3H6(g)+H2(g) ΔH=+bkJ·mol-1(b>0)的反应中,反应物具有的总能量________(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要________(填“放出”或“吸收”)能量才能转化为生成物。
(3)关于用水制取二次能源氢气,以下研究方向不正确的是(________)
A.组成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二次能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊催化剂,用于开发廉价能源,以分解水制取氢气
(4)已知下列两个热化学方程式:
A、2H2(g)+O2(g)![]() 2H2O(l) △H=-571.6kJ·mol-1
2H2O(l) △H=-571.6kJ·mol-1
B、C3H8(g)+5O2(g)![]() 3CO2(g)+4H2O(l) △H=-2220kJ·mol-1
3CO2(g)+4H2O(l) △H=-2220kJ·mol-1
其中,能表示燃烧热的热化学方程式为__________,其燃烧热△H=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品安全一直是社会关注的话题。过氧化苯甲酰(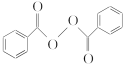 )过去常用作面粉增白剂,但目前已被禁用。合成过氧化苯甲酰的流程图如下:
)过去常用作面粉增白剂,但目前已被禁用。合成过氧化苯甲酰的流程图如下:
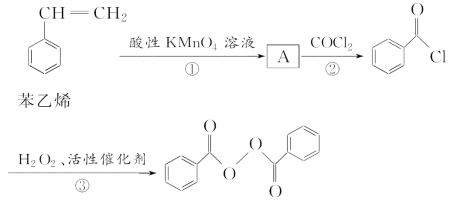
请回答下列问题:
(1)A的结构简式为________________;②的反应类型为________________。
(2)写出反应③的化学方程式:_________________________________________
过氧化苯甲酰在酸性条件下水解的化学方程式为__________________________________。
(3)下列有关苯乙烯的说法正确的是______(填字母)。
A.苯乙烯能使溴水褪色 B.苯乙烯存在一种同分异构体,其一氯代物仅有一种
C.苯乙烯分子中8个碳原子可能共平面 D.苯乙烯、庚烷燃烧耗氧量肯定相等
(4)写出一个符合下列要求的过氧化苯甲酰的同分异构体的结构简式______________。
①分子中不含碳碳双键或三键;
②分子中只含有一种含氧官能团;
③核磁共振氢谱有3组峰,其峰面积之比为1∶2∶2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的原理及电池中发生的主要反应如下图所示,下列说法不正确的是

A. X极为电池的负极 B. 电池工作时,光能转变为电能
C. 电池工作时,Y极上发生还原反应 D. 电池的电解质溶液中I-和I3-的浓度不断减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com