
����Ŀ��ijѧ����NaOH����Һ�ζ�δ֪Ũ�ȵ����ᣬ����������ʵ�飺ȡ15 mL������Һ��250 mL��ƿ�У�����1~2�η�̪��Һ����NaOH����Һ�ζ��������������������ظ�2�Ρ�
��1����գ���������С����ѡ����ƫ��������ƫ����������Ӱ������
��װ��ζ���������ˮϴ�Ӻ�ֱ�Ӽ���NaOH����Һ���еζ��������Һ��Ũ��________��
����ƿ������ˮϴ�Ӻ�ˮδ��������ζ�ʱ��ȥNaOH����Һ�����________��
�۵ζ�ʱ�ߵα�ҡ����ƿ���۾�Ӧ�۲�________________________��
���ζ��ﵽ�յ�ʱ����ָ̪ʾ����________ɫ���________ɫ��
��2���ζ�������±���ʾ��
�ζ����� | ����Һ�����/mL | ����������Һ�����/ mL | |
�ζ�ǰ�̶� | �ζ���̶� | ||
1 | 1.05 | 21.10 | 15.00 |
2 | 2.00 | 21.95 | 15.00 |
��NaOH����Һ��Ũ��Ϊ0.1010 mol/L�������Һ��Ũ��Ϊ________��
���𰸡�ƫ�� ��Ӱ�� ��ƿ����Һ��ɫ�ı仯 �� dz�� 0.1347 mol/L
��������
�жϵζ������Դ���ҺŨ�ȵ�Ӱ��ʱ�����dz�ʹ�ù�ʽ������ʹ��![]() �����Ҳ���c(��)�Ƿ�ı䣬����ʱ��c(��)=��֪���ݡ�
�����Ҳ���c(��)�Ƿ�ı䣬����ʱ��c(��)=��֪���ݡ�
(1)��װ��ζ���������ˮϴ�Ӻ�ֱ�Ӽ���NaOH����Һ���еζ�����Һ��Ũ�ȼ�С������������������ô���Һ��Ũ��ƫ�ߡ��𰸣�ƫ��
����ƿ������ˮϴ�Ӻ�ˮδ��������δ֪Һ�����ʵ������䣬��ζ�ʱ��ȥNaOH����Һ�������Ӱ�졣�𰸣���Ӱ��
�۵ζ�ʱ�ߵα�ҡ����ƿ���۾�Ӧ�۲���ƿ����Һ��ɫ�ı仯��
��Ϊ����ƿ����Һ��ɫ�ı仯
���ζ��ﵽ�յ�ʱ����ָ̪ʾ������ɫ���dz��ɫ���𰸣��ޡ�dz��
(2)����ʵ������NaOH����Һ�����ȡƽ��ֵΪ20.00mL�����빫ʽ��⣺
![]()
����0.1347 mol/L


 ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O������������ȷ���ǣ�������
5NaCl+NaClO3+3H2O������������ȷ���ǣ�������
A.Cl2����������NaOH�ǻ�ԭ��
B.����������ԭ�Ӻͱ���ԭ����ԭ�ӵ����ʵ���֮��Ϊ5��1
C.Cl2����������������ԭ��
D.�������õ������뻹ԭ��ʧ������֮��Ϊ5��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�ĵ���ƽ���У�c(H��)��c(OH��)�Ĺ�ϵ��ͼ��ʾ��
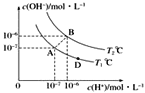
(1)A��ˮ�����ӻ�Ϊ1��10��14��B��ˮ�����ӻ�Ϊ___�����ˮ�����ӻ��仯��ԭ����________��
(2)����˵����ȷ����___��
a��A��B��D���㴦Kw�Ĵ�С��ϵ��B>A>D b��AB������������Һ��������
c��B����Һ��pH��6�������� d��ͼ���¶�T1>T2
(3)T2��ʱ��������Һ�еμ����ᣬ�ܷ�ʹ��ϵ����B��λ�ã�___Ϊʲô��___________��
(4)T2��ʱ����������c(H��)��5��10��4mol��L��1������ˮ���������c(H��)��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��֬�ĽṹƬ����ͼ��ʾ�����й��ڸ���֬��˵������ȷ���ǣ� ����ͼ��~~~��ʾ���ӳ���
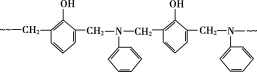
A.�ϳɸ���֬�ķ�ӦΪ���۷�Ӧ
B.�����Ϻϳɸ���֬��ԭ�ϱ�����ͬ
C.�ϳɸ���֬�ĵ���֮һ��ȩ���ɼ״������õ�
D.����֬������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� ��400mLijŨ�ȵ�ϡ�����м���Wg���ۣ���ԭ����ֻ��NO������ַ�Ӧ�����ۼ���16.8 g��������ʣ��,�����������м���������ϡ���ᣬ���������A���ش��������⣺
��1��ϡ��������ʵ���Ũ����_____________ mol��L1
��2������A��������H2����W��ֵһ��Ҫ����__________g.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������ͼ��ʾװ��ģ��ʯ��ʯȼú��������ʵ�飺

��1��ʵ����Ϊ���ʯ��ʯ��Һ����Ч�ʲ�ȡ�Ĵ�ʩ��____��д��ͨ��SO2�Ϳ���������Ӧ����ʯ��(CaSO4��2H2O)�Ļ�ѧ����ʽ____��
��2��������������ͨ��KMnO4��Һ���ɴ����ж���������Ч�ʵķ�����____��
��3���о�����ʯ��ʯ��Һ������Ч����pH���¶ȵ�Ӱ�졣��������һ��ʱ������Ч����ʯ��ʯ��ҺpH�Ĺ�ϵ��ͼ��ʾ����Ϊ5.7ʱ����Ч����ѣ�ʯ��ʯ��Һ5.7��pH��6.0ʱ����������Ч�����͵Ŀ���ԭ����____������ͨ��ʯ��ʯ��Һʱ���¶Ȳ��˹��ߣ�����Ϊ____��

��4��ʯ��ʯ��������õ��������е���Ҫ�ɷ���CaSO4��CaSO3��ʵ����Ա���ⶨʯ��ʯ��Һ������������CaSO3�ĺ������Ծ���ȼú��������ʱͨ������������벹�������ⶨCaSO3������ʵ�鷽����ȡһ����ʯ��ʯ�������������ʣ�____��[��Һ��CaSO3�ܳ�������ᷴӦ��ʵ������ʹ�õ�ҩƷ��75%�����ᡢ��Ũ�ȵ�(NH4)2Fe(SO4)2��Һ����Ũ�ȵ�����KMnO4��Һ]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ������ˮ��Һ��ֻ���ܺ������������е������֣�K+����NH4+��Cl����Mg2+��Ba2+��CO32����SO42������ȡ���� 100mL ��Һ��������ʵ�飺��1����һ�ݼ��� AgNO3 ��Һ�г�����������2���ڶ��ݼ����� NaOH ��Һ���Ⱥ��ռ������� 0.04mol����3�������ݼ����� BaCl2 ��Һ�ø������ 6.27g������������ϴ�ӡ������������Ϊ 2.33g����������ʵ�飬�����Ʋ���ȷ���ǣ� ��
A.Cl�����ܴ���B.Ba2+һ�������ڣ�Mg2+���ܴ���
C.c(K+)=0.1mol/LD.100mL ��Һ�к��� 0.01mol CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽����ҵ������Ӵ����еķ�Ӧ�������ͼ��ʾװ�ã����ⶨ�������¶��������ת���ʡ�
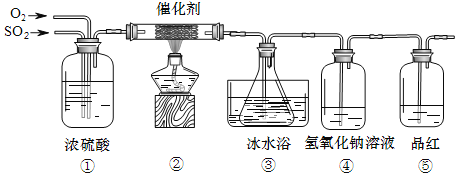
��1������Ũ��������ó���ͨ���۲����ݣ���������������⣬����_____��_____��
��2������ƿ��ʢ�ŵ����������Ȼ�����Һ��ʵ����̹۲쵽��ƿ�в�����ɫ��������Ӧ�Ļ�ѧ����ʽΪ_____����ƿ�����ˮԡ��ԭ����_____��
��3������Ʒ����ɫû�з����ı䣬˵��_____��
��4����ͨ��SO2�����ΪV L��������Ϊ��״���µ��������Ҫ�ⶨ�������¶��������ת���ʣ�ʵ��ʱ����Ҫ�ⶨ��������m g����m������_____���������¶��������ת������_____����ʽ��ʾ����
��5����Ӧ��������ͨ��N2��ԭ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1.12g���ۼ���25mL 2molL��1���Ȼ�����Һ�У���ַ�Ӧ�������ǣ� ��
A. ����ʣ�࣬��Һ��dz��ɫ��Cl��Ũ�Ȼ�������
B. ����Һ�е�����ɫKSCN��Һ���Ի�ɫ
C. Fe2+��Fe3+�����ʵ���֮��Ϊ6��1
D. ���������뻹ԭ��������ʵ���֮��Ϊ2��5
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com