
����Ŀ����ˮ�ĵ���ƽ���У�c(H��)��c(OH��)�Ĺ�ϵ��ͼ��ʾ��
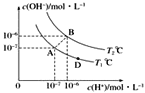
(1)A��ˮ�����ӻ�Ϊ1��10��14��B��ˮ�����ӻ�Ϊ___�����ˮ�����ӻ��仯��ԭ����________��
(2)����˵����ȷ����___��
a��A��B��D���㴦Kw�Ĵ�С��ϵ��B>A>D b��AB������������Һ��������
c��B����Һ��pH��6�������� d��ͼ���¶�T1>T2
(3)T2��ʱ��������Һ�еμ����ᣬ�ܷ�ʹ��ϵ����B��λ�ã�___Ϊʲô��___________��
(4)T2��ʱ����������c(H��)��5��10��4mol��L��1������ˮ���������c(H��)��____��
���𰸡�1��10��12 ˮ�ĵ���Ҫ���ȣ��¶����ߣ�ˮ�ĵ���̶��������ӻ����� b �� ��������c(H��)��c(OH��)�����Բ����ܴ���B��λ�� 2��10��9mol��L��1
��������
(1)���������е����ݣ�����֪��B��ˮ�����ӻ�Ϊ1��10-12��ˮ�ĵ�����������ȹ��̣��¶�Խ�ߣ�ˮ�����ӻ���Խ��
��Ϊ��1��10��12 ��ˮ�ĵ���Ҫ���ȣ��¶����ߣ�ˮ�ĵ���̶��������ӻ�����
(2) a��ͼ��A��D�������ͬһ�����ϣ���Kw��ȣ���a����
b��AB������������c(H+ )=c(OH- )�������ԣ���b��ȷ��
c��B��c(H+ )=c(OH- )�������ԣ���c����
d��A��B��Kw��ǰ��С�ں��ߣ��¶�Խ�ߣ�ˮ�����ӻ�����Խ������ߴ������¶ȸߣ���T1С��T2����d����
��ѡb��
(3) T2��ʱ��������Һ�еμ����ᣬ c(H+ )��c(OH- )�������ܴ���B��λ�á�
��Ϊ������������c(H��)��c(OH��)�����Բ����ܴ���B��λ�ã�
(4) T2��ʱ����Kw=c(H+)��c(OH- )�ɵ�c(H+ )ˮ=![]() mol��L��1=2��10-9 mol��L��1��
mol��L��1=2��10-9 mol��L��1��
����2��10��9mol��L��1��


 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧС��ʵ��̽��KI��FeCl3����KCl��I2��FeCl2�ķ�Ӧ����һ���ȡ�
ʵ�飺i����5mL0.1mol/L KI��Һ�еμ�5��6��0.1mol/L FeCl3��Һ����ַ�Ӧ��������Һ�ֳɼס��ҡ������ȷݣ�
��������еμ�CCl4�������
���������еμ��Լ�X��
(1)��KI��FeCl3��Ӧ�����ӷ���ʽ����������_____I-+___Fe3+![]() ______I2+_______Fe2+
______I2+_______Fe2+
(2)���袣�У��Լ�X��_____________��
(3)���袢�͢���ʵ�������У���˵�����з�Ӧ����һ���ȵ�ʵ��������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Fe��FeO��Fe2O3��ɵĻ�����м���100mL2mol/L�����ᣬǡ��ʹ�������ȫ�ܽ⣬���ų�448mL���壨��״��������ʱ��Һ����Fe3+���ӣ��������ж���ȷ����
�ٻ�������������ʷ�Ӧʱ������������ʵ���֮��Ϊ1:1:3
�ڷ�Ӧ��������Һ�е�Fe2+������Cl-���ӵ����ʵ���֮��Ϊ1:2
�ۻ�����FeO�����ʵ�����ȷ������Fe��Fe2O3�����ʵ�����
�ܻ�����Fe2O3�����ʵ�����ȷ������Fe��FeO�����ʵ�����
A.�ڢ�B.�٢�C.�ڢ�D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����600mLij�ֻ������Һ��ֻ���ܺ������������е�������![]()
![]() ��
��![]() ��
��![]() ���ֽ�����Һ�ֳ����ȷݣ���������ʵ��
���ֽ�����Һ�ֳ����ȷݣ���������ʵ��
�����һ���м���AgNO3��Һ���г���������
����ڶ����м�����NaOH��Һ�����Ⱥ��ռ�������0.04 mol����![]() ����Ϊ���ȣ�
����Ϊ���ȣ�
����������м�����BaCl2��Һ�ø���ij���6.27g������������ϴ�ӡ������������Ϊ2.33g��
��������ʵ�飬�����Ʋ������ǣ� ��
A.K+һ������
B.Ba2+��Mg2+һ������
C.Cl- һ������
D.�����Һ��![]() ��Ũ��Ϊ0.1 mol/L
��Ũ��Ϊ0.1 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ��һ������Ũ���ᷴӦ���õ�����ͭ��Һ��NO2��NO�Ļ�����壬��Щ������1.68L O2����״������Ϻ�ͨ��ˮ�У�����������ȫ��ˮ�����������ᡣ������������ͭ��Һ�м���6molL��1NaOH��Һ��Cu2+ǡ����ȫ������������NaOH��Һ������ǣ�������
A.60 mLB.45 mLC.30 mLD.50 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ϊ̽��ͭ��Ũ����ķ�Ӧ������ͼװ�ý����й�ʵ�顣��ش�
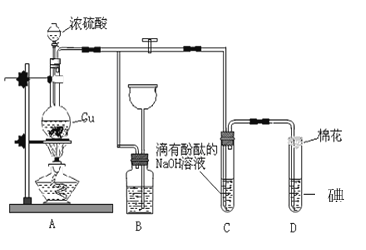
��1��װ��A�з����Ļ�ѧ��Ӧ�Ļ�ѧ����ʽ�� _________________________________��
��2��װ��B ��������__________________��B�й��ƿ��Ӧʢ�ŵ�Һ����_________(�����)
��ˮ �ڳ���ʯ��ˮ
��Na2CO3��Һ �ܱ��͵�NaHSO3 ��Һ
��3��װ��C��D �в�����������ͬ����ԭ��ȴ��ͬ��C�з�Ӧ�ķ���ʽ��_______________________________________����D ����������SO2 ����_______�ԣ�D�з�Ӧ�ķ���ʽ��________________________��
��4��ʵ���У�0.1molCu�뺬0.2mol�������Һ��Ӧ��ͭ�����ᶼ��ʣ�ࡣ ����֤���������ʵ�鷽����___________
A�����ټ���п�� B�����ټ����Ȼ�����Һ
C���ټ������� D���ٵ���̼��������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��NaCl��Na2CO3��10H2O��NaHCO3�Ļ���ijͬѧ�����ͼ��ʾ��ʵ��װ�ã�ͨ��������Ӧ������CO2��H2O����������ȷ���û�����и���ֵ�����������

(1)ʵ�鲽�裺
�ٰ�ͼ(�г�����δ����)��װ��ʵ��װ�ú����Ƚ��еIJ�����__________��
�ڳ�ȡ��Ʒ�����������Ӳ�ʲ������У�����װŨ�����ϴ��ƿC��������װ��ʯ�ҵ�U�ι�D��������
�۴���K1��K2���ر�K3������������������ӣ���Ŀ����________��
�ܹرջ���K1��K2����K3����ȼ�ƾ��Ƽ��������ٲ������塣װ��B�з�����Ӧ�Ļ�ѧ����ʽΪ________��________��
�ݴ���K1������������������ӣ�Ȼ�����װ�ã��ٴγ���ϴ��ƿC��������U�ι�D��������
(2)���ڸ�ʵ�鷽������ش��������⡣
�������ȷ�Ӧ����������Բⶨ�����Ӱ����_______________��
��E���������ʢ�ŵ�ҩƷ�Ǽ�ʯ�ң���������_____________�����ʵ����û�и�װ�ã���ᵼ�²������NaHCO3������_____________(����ƫ������ƫС��������Ӱ����)��
������Ʒ����Ϊw g����Ӧ��C��Dװ�����ӵ������ֱ�Ϊm1g��m2g����������Na2CO3��10H2O����������Ϊ________(�ú�w��m1��m2�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����NaOH����Һ�ζ�δ֪Ũ�ȵ����ᣬ����������ʵ�飺ȡ15 mL������Һ��250 mL��ƿ�У�����1~2�η�̪��Һ����NaOH����Һ�ζ��������������������ظ�2�Ρ�
��1����գ���������С����ѡ����ƫ��������ƫ����������Ӱ������
��װ��ζ���������ˮϴ�Ӻ�ֱ�Ӽ���NaOH����Һ���еζ��������Һ��Ũ��________��
����ƿ������ˮϴ�Ӻ�ˮδ��������ζ�ʱ��ȥNaOH����Һ�����________��
�۵ζ�ʱ�ߵα�ҡ����ƿ���۾�Ӧ�۲�________________________��
���ζ��ﵽ�յ�ʱ����ָ̪ʾ����________ɫ���________ɫ��
��2���ζ�������±���ʾ��
�ζ����� | ����Һ�����/mL | ����������Һ�����/ mL | |
�ζ�ǰ�̶� | �ζ���̶� | ||
1 | 1.05 | 21.10 | 15.00 |
2 | 2.00 | 21.95 | 15.00 |
��NaOH����Һ��Ũ��Ϊ0.1010 mol/L�������Һ��Ũ��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ�����о�DZˮͧ�й�����ϵ��Ӧ������װ��ͼ(�г�������)��
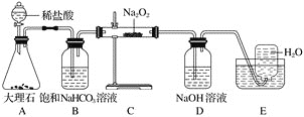
��1��Aװ��ΪCO2�ķ���װ�ã���Ӧ�����ӷ���ʽΪ____________________��
��2��Bװ�ÿɳ�ȥAװ���п��ܻӷ�����___________����Ӧ�����ӷ���ʽΪ_______________��
��3��Cװ��ΪO2�ķ���װ�ã���Ӧ�Ļ�ѧ����ʽΪ__________________��________________��
��4��Dװ�ÿɳ�ȥCװ����δ��Ӧ��__________����Ӧ�����ӷ���ʽΪ____________________��
��5��Eװ��Ϊ��ˮ���ռ�O2��װ�ã��������ռ�������ΪO2�ķ���Ϊ_____________________��
��6��Cװ���й����ɵ���ɫ��ȫ��Ϊ��ɫ���������ɷֵ�ʵ�鷽��Ϊȡ����Cװ���з�Ӧ��Ĺ�������ˮ������Һ�е������___��Һ�����а�ɫ�������ɣ���֤�������к���___�����ˣ�����Һ�е��뼸�η�̪��Һ����__�Ҳ���ɫ����֤�������к���__��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com