
【题目】对于反应3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C.Cl2既做氧化剂又做还原剂
D.氧化剂得电子数与还原剂失电子数之比为5∶1
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】烷、烯、炔都是常见的碳氢化合物。
(1)写出下列有机物的系统命名法名称:
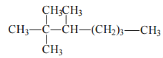 名称是______________________________
名称是______________________________
(2)有下列有机物:①CH3CH3②CH2=CH2③CH3-CH2-C≡CH④CH3-C≡C-CH3⑤C2H6⑥CH3-CH=CH2,其中互为同系物的是__________,互为同分异构体的是_________(填编号)
(3)实验室常用浓硫酸和乙醇混合加热制取乙烯。
①实验室制乙烯的化学方程式为_____________________________________。
②关于该实验的说法中正确的是(________)
a.浓硫酸只有催化剂的作用 b.可用向下排空气法收集乙烯
c.在反应容器中放入几片碎瓷片防止混合液暴沸 d.温度计应插入反应溶液液面下,以便控制温度
③实验后期制得的乙烯气体中常含有杂质气体![]() 和
和![]() ,将此混合气体直接通入溴水中,若观察到溴水褪色,能否证明乙烯发生了加成反应?__________(填“能”或“否”),原因是_________________________________________________________。
,将此混合气体直接通入溴水中,若观察到溴水褪色,能否证明乙烯发生了加成反应?__________(填“能”或“否”),原因是_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组实验探究KI和FeCl3生成KCl、I2和FeCl2的反应存在一定限度。
实验:i.向5mL0.1mol/L KI溶液中滴加5~6滴0.1mol/L FeCl3溶液。充分反应后,将所得溶液分成甲、乙、丙三等份;
ⅱ.向甲中滴加CCl4,充分振荡;
ⅲ.向乙中滴加试剂X。
(1)将KI和FeCl3反应的离子方程式补充完整。_____I-+___Fe3+![]() ______I2+_______Fe2+
______I2+_______Fe2+
(2)步骤ⅲ中,试剂X是_____________。
(3)步骤ⅱ和ⅲ的实验现象中,能说明①中反应存在一定限度的实验现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂钴合金在磁控、仪表等领域有重要用途。回答下列问题:
(1)基态Co原子价层电子的轨道表达式为___________;Co与Ca处于同一周期,且核外最外层电子构型相同,但金属Co的熔点比金属Ca的高,原因为________________。
(2)Pt与Cl、吡啶(![]() )能形成如图所示两种分子。
)能形成如图所示两种分子。

①吡啶中所含同周期元素的第一电离能由小到大的顺序为________________。
②1mol化合物Ⅰ中含有![]() 键的数目为__________________。
键的数目为__________________。
③相同条件下,两种化合物中在水中溶解度更大的为__(填“Ⅰ”或“Ⅱ”),原因为____。
(3)某Pt-Co合金的晶体堆积模型为面心立方堆积,其中Co原子处于顶角位置、Pt原子处于面心位置,则该合金的化学式为_______。
(4)![]() 可用于检验可卡因。其中阴离子的立体构型为__,碳原子的杂化形式为____。
可用于检验可卡因。其中阴离子的立体构型为__,碳原子的杂化形式为____。
(5)![]() 是一种磁性材料,其晶胞结构如图甲所示,俯视图如图乙所示。
是一种磁性材料,其晶胞结构如图甲所示,俯视图如图乙所示。

①原子坐标参数:A为(0,0,0);B为(0.31,0.31,0)。则C原子的坐标参数为__。
②若阿伏加德罗常数的值为![]() ,则晶体密度为___
,则晶体密度为___![]() (列出计算表达式)。
(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g)![]() 2C(g)达到平衡状态标志的是( )
2C(g)达到平衡状态标志的是( )
①C生成的速率与C分解的速率相等;②单位时间内生成a mol A,同时生成3a mol B;③A、B、C的浓度不再变化;④A、B、C的压强不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦单位时间内消耗a mol A,同时生成3a mol B;⑧A、B、C的分子数之比为1∶3∶2
A.②⑧B.①⑥C.②④D.③⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计CO2熔盐捕获与转化装置如图1,可与太阳能电池(装置如图2)联合实现绿色转化。下列有关说法错误的是( )

A.c接太阳能电池的P电极
B.CO2与熔盐发生氧化还原反应生成CO32-和C2O52-
C.d极电极反应式为CO32-+4e-=C+3O2-
D.理论上转移4mol电子可捕获标准状况下CO222.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在由Fe、FeO和Fe2O3组成的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中无Fe3+离子,则下列判断正确的是
①混合物里三种物质反应时消耗盐酸的物质的量之比为1:1:3
②反应后所得溶液中的Fe2+离子与Cl-离子的物质的量之比为1:2
③混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
④混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
A.②③B.①④C.②④D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有600mL某种混合物溶液,只可能含有以下离子中的若干种![]()
![]() 、
、![]() 、
、![]() ,现将此溶液分成三等份,进行如下实验
,现将此溶液分成三等份,进行如下实验
①向第一份中加入AgNO3溶液,有沉淀产生;
②向第二份中加足量NaOH溶液并加热后,收集到气体0.04 mol;(![]() 条件为加热)
条件为加热)
③向第三份中加足量BaCl2溶液后,得干燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下推测错误的是( )
A.K+一定存在
B.Ba2+、Mg2+一定不存
C.Cl- 一定存在
D.混合溶液中![]() 的浓度为0.1 mol/L
的浓度为0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用NaOH标准溶液滴定未知浓度的盐酸,进行了如下实验:取15 mL待测溶液于250 mL锥形瓶中,加入1~2滴酚酞试液,用NaOH标准溶液滴定。按上述操作方法再重复2次。
(1)填空:(①、②小题中选填“偏高”、“偏低”或“无影响”)
①装碱滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则待测液的浓度________;
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________;
③滴定时边滴边摇动锥形瓶,眼睛应观察________________________;
④滴定达到终点时,酚酞指示剂由________色变成________色。
(2)滴定结果如下表所示:
滴定次数 | 标准溶液的体积/mL | 待测盐酸溶液的体积/ mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 1.05 | 21.10 | 15.00 |
2 | 2.00 | 21.95 | 15.00 |
若NaOH标准溶液的浓度为0.1010 mol/L,则待测液的浓度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com