
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如下:
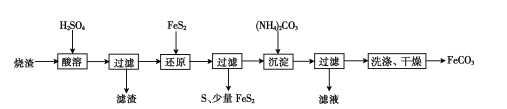
已知:“还原”时,FeS2与H2SO4不反应。
(l)“酸溶”时Fe2O3发生的化学反应方程式为________
(2)实验室“过滤”时所用的玻璃仪器有烧杯、________
(3)“还原”时生成S的离子方程式为________
(4)检验FeCO3是否洗净的方法是________
(5)“滤液”中的溶质可能有____(填化学式)。
【答案】Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O 漏斗、玻璃棒 FeS2+2Fe3+= 3Fe2++2S 取少许最后一次洗涤液于试管中,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,若无白色沉淀生成,则表明沉淀已洗涤干净,反之,则说明没洗涤干净 (NH4)2SO4、(NH4)2CO3
【解析】
烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)用硫酸浸取,Fe2O3、FeO溶解,过滤后滤液中含有硫酸铁、硫酸亚铁、未反应的硫酸,滤渣为二氧化硅,用FeS2还原Fe3+后过滤,得到的滤液中含有硫酸亚铁,向滤液中加入碳酸铵,过滤得碳酸亚铁,滤液中有硫酸铵和过量的碳酸铵。
(l)“酸溶”时Fe2O3发生的化学反应方程式为:Fe2O3+ 3H2SO4= Fe2(SO4)3 + 3H2O。答案为:Fe2O3+ 3H2SO4= Fe2(SO4)3 + 3H2O
(2)实验室“过滤”时所用的玻璃仪器除了烧杯,还需要漏斗、玻璃棒。答案为:漏斗、玻璃棒
(3)根据题意,“还原”时FeS2与H2SO4不反应,可判断,是Fe3+和FeS2反应生成S,离子方程式为:FeS2+2Fe3+= 3Fe2++2S。答案为:FeS2+2Fe3+= 3Fe2++2S
(4)FeCO3是从硫酸铵溶液中分离出来的,洗涤是否干净可以通过检验硫酸根离子来证明,所以检验沉淀已洗净的方法是:取少许最后一次洗涤液于试管中,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,若无白色沉淀生成,则表明沉淀已洗涤干净,反之,则说明没洗涤干净。答案为:取少许最后一次洗涤液于试管中,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,若无白色沉淀生成,则表明沉淀已洗涤干净,反之,则说明没洗涤干净
(5)流程中加入碳酸铵后,原溶液中的硫酸亚铁和没有反应完的硫酸均反应:FeSO4+(NH4)2CO3===FeCO3↓+(NH4)2SO4, H2SO4+(NH4)2CO3===(NH4)2SO4+CO2↑+ H2O,为使FeSO4完全沉淀,需加入过量的(NH4)2CO3,所以过滤后滤液中的溶质可能有(NH4)2SO4和(NH4)2CO3。答案为:(NH4)2SO4、(NH4)2CO3


科目:高中化学 来源: 题型:
【题目】烯烃是重要的有机化合物.其中乙烯是最简单的一种烯烃,其产量代表着一个国家石油化工产业的水平。
完成下列问题:
(1)实验室用如图所示装置制取乙烯,反应方程式是____,无水乙醇与浓硫酸的体积比为1:3,请解释加入浓硫酸不宜过少的原因是__。

(2)反应需要迅速升温至所需温度的理由是___。所以烧瓶中应放入的固体物质是___,其作用是____。
(3)烯烃通过催化加氢可以得到烷烃。请写出一种可以通过催化加氢反应得到2,2-二甲基丁烷的结构简式:___。
(4)有一种烷烃A,分子式C9H20,它却不能由任何C9H18的烯烃催化加氢得到。请写出A的结构简式___,在A的同分异构体中,却存在只能由1种烯烃催化加氢得到的烷烃,请写出一种符合要求的A的同分异构体的结构简式:___。
烯烃还可以与卤素单质、卤化氢、水发生加成反应,产物有主次之分,例如:


(5)化学式为C4H8的某烃A与HBr加成得到的主要产物,其一氯代物只有一种,请写出A发生聚合反应的方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究Cu与浓硝酸反应时发现如下现象:
装置与试剂 | 现象 |
| Cu片完全溶解,产生红棕色气体,得到绿色溶液A,该溶液长时间放置后得到蓝色溶液B。反应后溶液体积几乎不变。 |
(1)Cu与浓硝酸反应的离子方程式为_____。
(2)甲同学猜测溶液A不是蓝色而呈绿色与溶解了NO2有关,于是向溶液B中通入NO2,然后再持续通入一段时间N2,观察到现象:_____,证实猜测合理。
甲同学为深入研究溶液A呈绿色的原因,查得如下资料并提出了新的假设:

假设一:A中形成了Cu(NO2)![]() 使溶液呈绿色。
使溶液呈绿色。
为了验证假设一的合理性,甲同学进行了如下实验:
(实验一)
操作 | 现象 |
①向20.0mL0.5mol·L-1Cu(NO3)2蓝色溶液中通入少量NO2气体 | 溶液呈绿色 |
②向20.0mL水中通入与①中等量的NO2气体 | 溶液呈无色 |
(3)操作②的目的是_____。
(4)乙同学向①所得溶液中滴加浓硫酸,使溶液中c(H+)达约8mol·L-1,观察到有无色气体放出(遇空气变为红棕色),溶液很快变回蓝色。利用平衡移动原理解释溶液变蓝的原因:_____。
(5)综合甲乙两位同学的实验,假设一不成立。请说明理由:______。
乙同学查得如下资料并提出来另一种假设:
![]()
假设二:A中浓硝酸溶解了NO2所得黄色溶液与Cu2+的蓝色复合形成的绿色。
为验证假设二的合理性,乙同学进行了如下实验:
(实验二)
操作 | 现象 |
①配制与溶液A的c(H+)浓度相同的HNO3溶液,取20.0mL,通入少量NO2气体 | 溶液呈黄色 |
②加入 | 溶液变为绿色 |
③…… | 溶液立即变回蓝色 |
(6)操作②中加入的试剂为_____。
操作③进一步证明了假设二的合理性,写出该操作:span>_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL0.01molL-1HA溶液中逐滴加入0.02molL -1MOH溶液,图中所示曲线表示混合溶液的pH变化情况体积变化忽略不计)。下列说法中不正确的是( )

A.MOH为一元弱碱
B.MA稀溶液pH<7
C.N点水的电离程度大于K点水的电离程度
D.K点对应的溶液的pH=10,则c(MOH)+c(OH)-c(H+)=0.01molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷和Cl2(g)反应的能量关系如图所示。下列叙述正确的是
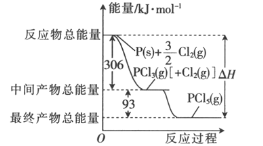
A.PCl5(g)比PCl3(g)稳定B.加入催化剂不会改变△H的大小
C.整个过程吸收的能量为399kJD.PCl3(g)的燃烧热△H=-93kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,在3支相同体积的试管中分别充有等体积的下列气体:①NO2,②HC1,③NH3。现将3支试管均倒置于水槽中,充分溶解后,所得溶液的物质的量浓度大小关系正确的是
A.①>②>③B.①=②=③C.②=③>①D.③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烷基烯酮二聚体(AKD)是造纸工业上常用的一种浆内施胶剂,其结构简式如图所示,下列说法正确的是( )
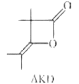
A.AKD的分子式为C8H14O2
B.AKD与NaOH溶液能发生皂化反应
C.AKD分子中所有碳原子处于同一平面
D.AKD能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组在T1温度下,向容积为1L的恒容密闭容器中,同时通入0.1mol CO(g)和0.1mol H2O(g),发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=a kJ·mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示。
CO2(g)+H2(g)△H=a kJ·mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示。

(1)0~10min内,CO的平均反应速率为_____________
(2)T1温度下,该反应的平衡常数K为_______________(用分数表示)。
(3)已知:I.H2的燃烧热 △H=-285.8 kJ·mol-1;
II.CO的燃烧热 △H=-283 kJ·mol-1;
III.H2O(g)![]() H2O(l) △H=-44 kJ·mol-1。则a=______________
H2O(l) △H=-44 kJ·mol-1。则a=______________
(4)T1温度下,某时刻另一实验小组测得反应容器中有关数据为c(CO)=0.6 mol·L-1、c(H2O)=1.6 mol·L-1、c(H2)=0.4 mol·L-1、c(CO2)=0.4 mol·L-1,则该反应在下一时刻将_______ (填“向正反应方向进行”“向逆反应方向进行”或“达到平衡”),判断依据是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镓(Ga)应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。
(1)铝在元素周期表中的位置是_________。
(2)GaAs 是一种重要的半导体材料。As 与 Ga 同周期,As 与 N 同主族。
①下列事实不能用元素周期律解释的是___________(填字母)。
a. 碱性:Ga (OH)3> Al (OH)3 b. 非金属性:As>Ga c. 酸性:H3AsO4>H3AsO3
②GaAs 中,As 元素化合价为-3 价,用原子结构理论解释原因_________________。
③废弃含 GaAs 半导体材料可以用浓硝酸溶解 GaAs,生成 H3AsO4 和 Ga3+,写出该反应的化学方程式_________。
(3)工业上获取镓的方法之一是从闪锌矿冶锌后的残渣(主要含有 Zn、Pb、Fe、Ga 等元素)中提取,某科研单位设计下述流程提取镓,已知:Ga 在碱性溶液中以[Ga(OH)4]- 形式存在。

①试剂 a 是_____。
②写出得到滤液 3 的离子方程式_______________。
③写出电解制镓时的阴极电极反应式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com