
【题目】某小组研究Cu与浓硝酸反应时发现如下现象:
装置与试剂 | 现象 |
| Cu片完全溶解,产生红棕色气体,得到绿色溶液A,该溶液长时间放置后得到蓝色溶液B。反应后溶液体积几乎不变。 |
(1)Cu与浓硝酸反应的离子方程式为_____。
(2)甲同学猜测溶液A不是蓝色而呈绿色与溶解了NO2有关,于是向溶液B中通入NO2,然后再持续通入一段时间N2,观察到现象:_____,证实猜测合理。
甲同学为深入研究溶液A呈绿色的原因,查得如下资料并提出了新的假设:

假设一:A中形成了Cu(NO2)![]() 使溶液呈绿色。
使溶液呈绿色。
为了验证假设一的合理性,甲同学进行了如下实验:
(实验一)
操作 | 现象 |
①向20.0mL0.5mol·L-1Cu(NO3)2蓝色溶液中通入少量NO2气体 | 溶液呈绿色 |
②向20.0mL水中通入与①中等量的NO2气体 | 溶液呈无色 |
(3)操作②的目的是_____。
(4)乙同学向①所得溶液中滴加浓硫酸,使溶液中c(H+)达约8mol·L-1,观察到有无色气体放出(遇空气变为红棕色),溶液很快变回蓝色。利用平衡移动原理解释溶液变蓝的原因:_____。
(5)综合甲乙两位同学的实验,假设一不成立。请说明理由:______。
乙同学查得如下资料并提出来另一种假设:
![]()
假设二:A中浓硝酸溶解了NO2所得黄色溶液与Cu2+的蓝色复合形成的绿色。
为验证假设二的合理性,乙同学进行了如下实验:
(实验二)
操作 | 现象 |
①配制与溶液A的c(H+)浓度相同的HNO3溶液,取20.0mL,通入少量NO2气体 | 溶液呈黄色 |
②加入 | 溶液变为绿色 |
③…… | 溶液立即变回蓝色 |
(6)操作②中加入的试剂为_____。
操作③进一步证明了假设二的合理性,写出该操作:span>_____。
【答案】Cu+4H++2![]() =Cu2++2H2O+2NO2↑ 溶液通入NO2后变绿,通入一段N2后又变蓝 证明NO2溶于水时没有颜色变化,排除这一因素在①中的干扰 加入浓硫酸后,温度升高且c(H+)增大,HNO2分解导致c(HNO2)下降,均引起平衡HNO2
=Cu2++2H2O+2NO2↑ 溶液通入NO2后变绿,通入一段N2后又变蓝 证明NO2溶于水时没有颜色变化,排除这一因素在①中的干扰 加入浓硫酸后,温度升高且c(H+)增大,HNO2分解导致c(HNO2)下降,均引起平衡HNO2![]()
![]() +H+逆向移动,c(
+H+逆向移动,c(![]() )下降,Cu2+(蓝色)+4
)下降,Cu2+(蓝色)+4![]()
![]() Cu(NO2)
Cu(NO2)![]() (绿色)逆向移动,溶液颜色由绿色变为蓝色 加酸后溶液变为蓝色,说明酸性较强的溶液A中
(绿色)逆向移动,溶液颜色由绿色变为蓝色 加酸后溶液变为蓝色,说明酸性较强的溶液A中![]() 不能大量存在,因此Cu(NO2)
不能大量存在,因此Cu(NO2)![]() 也不能大量存在,不是溶液A呈绿色的主要原因 0.01ml molCu(NO3)2 加水稀释
也不能大量存在,不是溶液A呈绿色的主要原因 0.01ml molCu(NO3)2 加水稀释
【解析】
本实验利用Cu与浓硝酸发生反应Cu+4H++2![]() =Cu2++2H2O+2NO2↑制取NO2时,根据实验现象提出猜测并研究溶液颜色变化的原因,结合平衡移动原理等知识解答相关现象出现的原因,根据控制变量法的原理进行实验设计。
=Cu2++2H2O+2NO2↑制取NO2时,根据实验现象提出猜测并研究溶液颜色变化的原因,结合平衡移动原理等知识解答相关现象出现的原因,根据控制变量法的原理进行实验设计。
(1)Cu与浓硝酸反应生成硫酸铜、NO2和H2O,反应的离子方程式为Cu+4H++2![]() =Cu2++2H2O+2NO2↑;
=Cu2++2H2O+2NO2↑;
(2)甲同学猜测溶液A不是蓝色而呈绿色与溶解了NO2有关,于是向溶液B中通入NO2,溶液变成绿色,然后再持续通入一段时间N2,目的是将NO2吹出,进一步确认NO2的影响,因此通入一段时间N2后溶液又变成蓝色;
(3)操作②是对比试验,可证明NO2溶于水时没有颜色变化,排除这一因素在①中的干扰;
(4)结合资料可知,由于加入浓硫酸后,温度升高且c(H+)增大,HNO2分解导致c(HNO2)下降,同时产生无色气体,均引起平衡HNO2![]()
![]() +H+逆向移动,c(
+H+逆向移动,c(![]() )下降,Cu2+(蓝色)+4
)下降,Cu2+(蓝色)+4![]()
![]() Cu(NO2)
Cu(NO2)![]() (绿色)逆向移动,所以溶液颜色由绿色变为蓝色;
(绿色)逆向移动,所以溶液颜色由绿色变为蓝色;
(5)根据题干信息,所用Cu和HNO3的量中HNO3过量,根据方程式可知,A存有大量HNO3,酸性很强,而加酸后溶液变为蓝色,说明酸性较强的溶液![]() 不能大量存在,因此Cu(NO2)
不能大量存在,因此Cu(NO2)![]() 也不能大量存在,不是溶液A呈绿色的主要原因,故假设一不成立;
也不能大量存在,不是溶液A呈绿色的主要原因,故假设一不成立;
(6)根据控制变量法,操作②中加入的试剂应与实验一相同,即为0.01ml molCu(NO3)2;
(7)根据资料ⅳ,稀硝酸中溶有少量NO2时呈无色,因此可采用稀释的方法。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学与环境、科学、技术密切相关。下列有关说法中正确的是( )
A.华为首款5G手机搭载了智能的7nm制程SoC麒麟980芯片,此芯片主要成分是二氧化硅
B.用于制作N95型口罩的“熔喷布”主要原料是聚丙烯,聚丙烯的分子长链上无支链
C.国产飞机C919用到的氮化硅陶瓷是传统有机非金属材料
D.侯氏制碱法的工艺过程中应用了物质溶解度的差异
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决污染、变废为宝,我国科研人员研究在新型纳米催化剂Na-Fe3O4和HMCM-22的表面将CO2转化为烷烃,其过程如图。
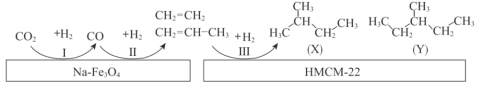
下列说法中,不正确的是( )
A.反应I、II、III均有副产物H2O产生
B.最终产物X、Y属于同系物
C.产物X名称为“2—甲基丁烷”或“异戊烷”
D.产物X、Y都有4种一氯代物(不考虑立体异构体)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(1)参加反应的HNO3和作为氧化剂的HNO3的个数比为________。
(2)若有64 g Cu被氧化,则被还原的HNO3的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应:2SO2(g) +O2(g) ![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达平衡时,可能存在的数据是
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达平衡时,可能存在的数据是
A. SO2为0.4mol/L
B. SO2为 0.25mol/L
C. SO2、SO3均为0.15mol/L
D. SO3为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应N2+3H2![]() 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A. 3v正(N2)=v正(H2)B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3)D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)ΔH1
CH3OH(g)ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3
CO(g)+H2O(g)ΔH3
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O |
| H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=________kJ·mol-1。
(2)反应①的化学平衡常数K表达式为________;图1中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是________。
图1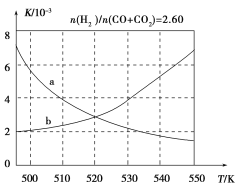
图2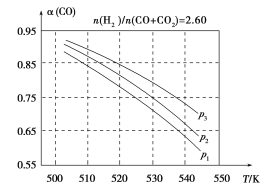
(3)合成气组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而________(填“增大”或“减小”),其原因是________________________________;图2中的压强由大到小为________,其判断理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如下:
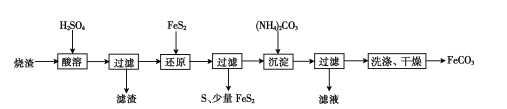
已知:“还原”时,FeS2与H2SO4不反应。
(l)“酸溶”时Fe2O3发生的化学反应方程式为________
(2)实验室“过滤”时所用的玻璃仪器有烧杯、________
(3)“还原”时生成S的离子方程式为________
(4)检验FeCO3是否洗净的方法是________
(5)“滤液”中的溶质可能有____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某恒温密闭容器中,投入一定量的A发生可逆反应:A(s)![]() B(g)+C(g) △H=-QkJ·mol-1(Q>0)。一段时间后反应达到平衡,然后缩小容器体积,重新达到平衡。下列分析不正确的是
B(g)+C(g) △H=-QkJ·mol-1(Q>0)。一段时间后反应达到平衡,然后缩小容器体积,重新达到平衡。下列分析不正确的是
A. 两次平衡时,C(g)的浓度相等
B. 平衡时,单位时间内:n(B)生成:n(C)消耗=1:1
C. 若开始时向容器中加入1 mol B和1 mol C,则达到平衡时吸收Q kJ热量
D. 若再向平衡体系中加入少量A,平衡不移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com