
甲醇汽油是由10%一25%的甲醇与其他化工原料、添加剂合成的新型车用燃料,可达到国标汽油的性能和指标。甲醇是一种可再生能源,具有广泛的开发和应用前景。
Ⅰ、工业上合成甲醇一般采用下列反应:CO(g)+2 H2(g) CH3 OH(g) △H=a
kJ/mol,
CH3 OH(g) △H=a
kJ/mol,
下表是该反应在不同温度下的化学平衡常数(K):
|
温度/0C |
250 |
310 |
350 |
|
K |
2.041 |
0.250 |
0.012 |
(1)由表中数据判断△H a 0(填“>”、“=”或“<”)。
(2)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.5 mol·L-1,则此时的温度为 0C。
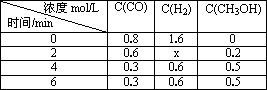
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
|
浓度mol/L 时间/min |
c(CO) |
c(H2) |
c(CH3OH)
|
|
0 |
0.8 |
1.6 |
0 |
|
2 |
0.6 |
1.2 |
0.2 |
|
4 |
0.3 |
0.6 |
0.5 |
|
6 |
0.3 |
0.6 |
0.5 |
①反应从2 min到4 min之间,H2的反应速率为 。
②反应达到平衡时CO的转化率为 。
③反应在第2 min时改变了反应条件,改变的条件可能是 (填序号)。
A.使用催化剂 B.降低温度 C.增加H2的浓度
(4)向容积相同、温度分别为T1和T2的两个密闭容器中均充入1 molCO和2 mol H2,发生反应CO(g)+2 H2(g)  CH3 OH(g)△H=a kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则
CH3 OH(g)△H=a kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则
w1 w2(填序号)。
A.大于 B.小于 C.等于 D.以上都有可能
Ⅱ、甲醇在化学电源方面也有着重要应用。写出以甲醇为燃料,氢氧化钠溶液为电解质溶液的原电池中负极的电极反应式: 。
Ⅰ(1)<(2分)
(2)310(2分)
(3)①0.3mol/(L·min)(2分,单位写错不得分) ②62.5%(2分,写小数也得分) ③A (2分)
(4)D(2分)
Ⅱ、2 CH3OH—12 e- +16 OH-=2CO32- + 12 H2O(2分,若“=”写成“→”不扣分,“e-”写成“e”扣1分,其它错误不得分)
【解析】
试题分析:(1)温度升高,K值减小,平衡向左移动,负反应吸热,故正反应放热。
(2)反应结束后,由CO浓度只CO物质的量为1mol。故CO反应量为1mol,剩余CO为1mol,即0.5mol/L,依次推出,H2反应了2mol,剩余H2为4mol,即2mol/L,生成甲醇1mol,即0.5mol/L,此时,反应平衡,K值为0.5/(0.5*2*2)=0.25,为310℃的平衡常数。
(3)①H2物质的量从1.2mol/L,反应成为0.6mol/L,时间经过2分钟,故反应速率为0.3mol/(L*min)
②容积固定,由0.8mol/L,转化到0.3mol/L,转化量为0.5mol/L,转化率为0.5/0.8=0.625
③2~4min内的反应速率大于0~2min 内的反应速率。故排除B,对比CO浓度的变化,排除C。
(4)本题关键是时间。如果时间很短,未充分反应,那么温度高的反应快,CO量少。但如果充分反应后,温度高的,因为平衡向左移动,CO量较多。故都有可能。
(5)其实是甲醇的燃烧反应与二氧化碳被氢氧化钠吸收的和反应。负极失去电子,C由负二价变为正四价,失去6 个电子,已知右边生成CO32-,由电荷守恒,左边OH-,应为8个,水自然补平。但6不是4(O2吸收电子数)的整数倍,故,整体乘2.
考点:考查反应热和化学反应速率。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:阅读理解

| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 化学键 | C-C | C-H | H-H | S-H | S-S | S-C |
| 键能/kJ.mol-1 | a | b | c | d | e | f |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1.容器 | 2.甲 | 3.乙 | 4.丙 |
| 5.反应物投入量 | 6.1molCO、2molH2 | 7.l molCH3OH | 8.2molCO、4molH2 |
| 9.CH30H昀浓度(mol/L) | 10.cl | 11.c2 | 12.c3 |
| 13.反应的能量变化 | 14.放出Q1kJ | 15.吸收Q2kJ | 16.放出Q3kJ |
| 17.平衡常数 | 18.Kl | 19.K2 | 20.K3 |
| 21.反应物转化率 | 22.al | 23.a2 | 24.a3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 温度/℃ | 250 | 310 | 350 |
| K | 2.041 | 0.250 | 0.012 |
| 浓度mol/L 时间/min |
c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | 1.2 | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
查看答案和解析>>
科目:高中化学 来源:浙江省杭州学军中学2011届高三第一次月考化学试题 题型:022
甲醇汽油是由10%-25%的甲醇与其他化工原料、添加剂合成的新型车用燃料,可达到国标汽油的性能和指标.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇一般采用下列反应:CO(g)+2H2(g)![]() CH3OH(g) △H=a kj/mol,
CH3OH(g) △H=a kj/mol,
下表是该反应在不同温度下的化学平衡常数(K):
(1)由表中数据判断ΔH a________0(填“>”、“=”或“<”).
(2)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.5 mol·L-1,则此时的温度为________℃.
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
①反应从2 min到4 min之间,H2的反应速率为________.
②反应达到平衡时CO的转化率为________.
③反应在第2 min时改变了反应条件,改变的条件可能是________(填序号).
a.使用催化剂
b.降低温度
c.增加H2的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com