
已知H+(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kJ·mol-1,回答下列问题。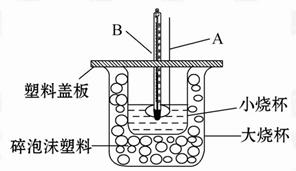
(1)仪器A的名称____ ___;碎泡沫塑料的作用是___________________。
(2)环形玻璃搅拌棒不能用环形铜质搅拌棒代替,其原因是______________ 。
(3)若通过实验测定中和热的ΔH的绝对值常常小于57.3 kJ/mol,其原因可能是_______
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(4)将V1mL1.0mol·L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。由下图可知,氢氧化钠的浓度为 ;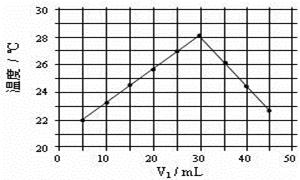
假设盐酸与氢氧化钠起始温度平均值为21.0℃,图中最高温度为28.0℃,并近似认为NaOH溶液和盐酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c="4.18" J/(g·℃)。则中和热ΔH = (取小数点后一位)。 (提示:Q=cmΔt)
(1)环形玻璃搅拌棒;保温隔离隔热作用。(2)铜棒易导致热量的散失。
(3)a、c、d (4) 1.5 mol·L-1-48.8 kJ·mol-1
解析试题分析:(1) 环形玻璃搅拌棒;保温隔离隔热作用。 (2) 铜棒易导致热量的散失。
(3)实验装置保温、隔热效果差导致一部分热量散失到外环境中。a正确
仰视读数时,实际取得的溶液量偏大,但加入烧杯中酸的量为定量,不影响ΔH。b错误
分多次把NaOH溶液倒入盛有盐酸的小烧杯中会导致盖板会被多次打开,热量散失。c正确
用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度会把盐酸带入NaOH溶液中,导致NaOH溶液不足。d正确
(4)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL。酸碱中和可列式:30mL× 1mol·L-1= 20mL×CNaOH,可求NaOH的浓度是1.5 mol·L-1。由Q=cmΔt得,该反应放出热量 Q = 50g×4.18 J/(g·℃)×(28℃-21℃)=1463J,且该反应Q所放出的热量为形成30ml×1mol/L=0.03mol水所放出的热量,故中和热ΔH =-1.463kJ÷0.03mol=-48.8 kJ·mol-1
考点:本题着重考查了中和热的实验过程相关知识。


科目:高中化学 来源: 题型:问答题
(14分)已知用NaAlO2制备α—Al(OH)3及能量转化关系如图: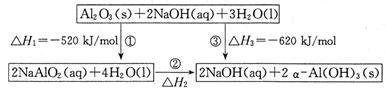
(1)反应②的热化学方程式为 。
(2)根据上述能量转化关系,拜耳公司找到了一种简捷的从铝土矿获取Al2O3的方法,流程如下: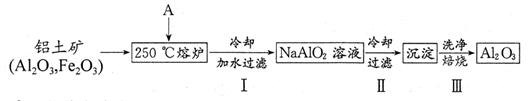
①物质A的化学式为 ;
②步骤Ⅲ的化学反应方程式为 ;检验步骤Ⅲ中沉淀是否洗净的方法是 ;
③步骤Ⅱ采用冷却的方法析出α—Al(OH)3,该措施的依据是 ;
④工业上可电解上述产物Al2O3以获得Al,若获得2.7kgAl,则理论上消耗A的物质的量至少为 mol。有人提出用熔融Na[AlCl4]与NaCl的混合物代替Al2O3进行电解获得Al,则阴极反应为 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
常温下钛的化学活性很小,在较高温度下可与多种物质反应。
(1)工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下: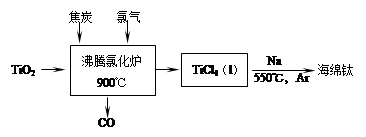
① 沸腾氯化炉中发生的主要反应为: 。
②已知:Ti(s) +2Cl2(g)=TiCl4(l) ΔH=a kJ·mol-1;
2Na(s) +Cl2(g)=2NaCl(s) ΔH=b kJ·mol-1;
Na(s)=Na(l) ΔH=c kJ·mol-1;
则TiCl4(l) +4Na(l)=Ti(s) +4NaCl(s) ΔH= kJ·mol-1。
③ TiCl4遇水强烈水解,写出其水解的化学方程式 。
(2)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如图所示,二氧化钛电极连接电 极,该极电极反应为: 。但此法会产生有毒气体,为减少对环境的污染,在电池中加入固体氧离子隔膜(氧离子能顺利通过),将两极产物隔开,再将石墨改为金属陶瓷电极,并通入一种还原性气体,该气体是 。
(3)海绵钛可用碘提纯,原理为: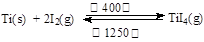 ,下列说法正确的是 。
,下列说法正确的是 。
| A.该反应正反应的ΔH>0 |
| B.在不同温度区域,TiI4的量保持不变 |
| C.在提纯过程中,I2 的作用是将粗钛从低温区转移到高温区 |
| D.在提纯过程中,I2 可循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用470 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从图中选择称量NaOH固体所需要的仪器是(填字母): 。
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | |||
| H2SO4 | NaOH | 平均值 | ||||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14 分) 一氧化碳被广泛应用于冶金工业和电子工业。
⑴高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) △H="a" kJ·mol-1
CO(g)+3Fe2O3(s)=CO2(g)+2Fe3O4(s) △H="b" kJ·mol-1
反应3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)的△H= kJ·mol-1(用含a、b 的代数式表示)。
⑵电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g) +CO(g) △H>0
CH3OH(g) +CO(g) △H>0
①第一步反应的机理可以用下图表示: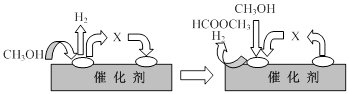
图中中间产物X的结构简式为 。
②在工业生产中,为提高CO的产率,可采取的合理措施有 。
⑶为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X—射线衍射谱图如图所示(X—射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为 。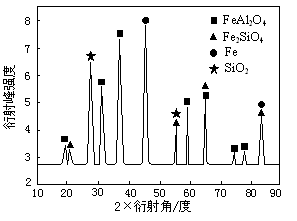
⑷某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2 g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4(沸点43 ℃),并在180 ℃时使Ni(CO)4重新分解产生镍单质。
上述两步中消耗CO的物质的量之比为 。
⑸为安全起见,工业生产中需对空气中的CO进行监测。
①粉红色的PdCl2溶液可以检验空气中少量的CO。若空气中含CO,则溶液中会产生黑色的Pd沉淀。每生成5.3gPd沉淀,反应转移电子数为 。
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图所示。这种传感器利用原电池原理,则该电池的负极反应式为 。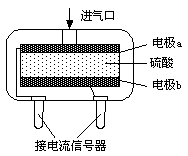
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
100 mL 6 mol·L-1的H2SO4溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
①Na2CO3溶液 ②水 ③K2SO4溶液 ④KNO3溶液
| A.①③ | B.②③ | C.①④ | D.②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定温度下,容器内某一反应中两种气态物质M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,反应达到平衡状态 |
| C.t3时,M上a点正反应速率等于N上b点的逆反应速率 |
D. 混一定时,N的体积百分含量也一定 混一定时,N的体积百分含量也一定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在密闭容器中进行反应:X(g)+3Y(g) 2Z(g),有关下列图像的说法正确的是
2Z(g),有关下列图像的说法正确的是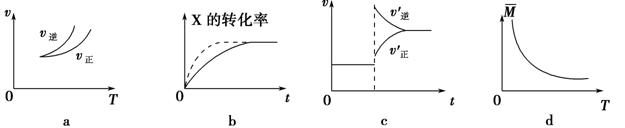
| A.依据图a可判断正反应为吸热反应 |
| B.在图b中,虚线可表示压强增大 |
| C.若正反应的ΔH<0,图c可表示升高温度使平衡向逆反应方向移动 |
| D.由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知2SO2 (g)+O2 (g)  2SO3 (g);△H =﹣197kJ?mol﹣1,向同温、同体积的三个密闭容器中分别充入气体,起始投料量如下表:
2SO3 (g);△H =﹣197kJ?mol﹣1,向同温、同体积的三个密闭容器中分别充入气体,起始投料量如下表:
| | SO2 (mol) | O2 (mol) | SO3 (mol) |
| 甲 | 2 | 1 | 0 |
| 乙 | 4 | 2 | 0 |
| 丙 | 0 | 0 | 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com