
在一定温度下,容器内某一反应中两种气态物质M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,反应达到平衡状态 |
| C.t3时,M上a点正反应速率等于N上b点的逆反应速率 |
D.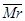 混一定时,N的体积百分含量也一定 混一定时,N的体积百分含量也一定 |
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:问答题
(10分)拆开1mol H—H键,1mol N—H键,1mol N≡N键分别需要吸收的能量为436kJ,391kJ,946kJ:则(1)1mol N2完全反应生成NH3 热量(填:吸收或放出) kJ;(2)理论上,每生成1mol NH3, 热量(填:吸收或放出) kJ;(3)事实上,反应的热量总小于理论值,为什么? 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
甲烷和氨在国民经济中占有重要地位。
(1)制备合成氨原料气H2,可用甲烷蒸汽转化法,主要转化反应如下:
CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH =" +206.2" kJ/mol
CO(g) + 3H2(g) ΔH =" +206.2" kJ/mol
CH4(g) + 2H2O(g)  CO2(g) +4H2(g) ΔH = +165.0kJ/mol
CO2(g) +4H2(g) ΔH = +165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
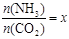 ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。求图中的B点处,NH3的平衡转化率。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。求图中的B点处,NH3的平衡转化率。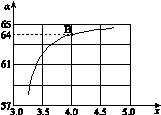
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
已知H+(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kJ·mol-1,回答下列问题。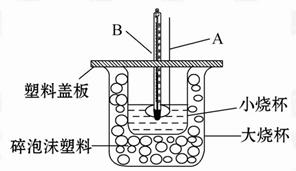
(1)仪器A的名称____ ___;碎泡沫塑料的作用是___________________。
(2)环形玻璃搅拌棒不能用环形铜质搅拌棒代替,其原因是______________ 。
(3)若通过实验测定中和热的ΔH的绝对值常常小于57.3 kJ/mol,其原因可能是_______
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(4)将V1mL1.0mol·L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。由下图可知,氢氧化钠的浓度为 ;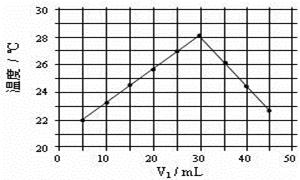
假设盐酸与氢氧化钠起始温度平均值为21.0℃,图中最高温度为28.0℃,并近似认为NaOH溶液和盐酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c="4.18" J/(g·℃)。则中和热ΔH = (取小数点后一位)。 (提示:Q=cmΔt)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
工业炼铁是在高炉中进行的,高炉炼铁的主要反应是:① 2C(焦炭)+O2(空气)=2CO;② Fe2O3+3CO=2Fe+3CO该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需其主要原因是
| A.CO过量 | B.CO与铁矿石接触不充分 |
| C.炼铁高炉的高度不够 | D.CO与Fe2O3的反应有一定限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在恒容密闭容器中,一定条件下进行如下反应:NO(g)+CO(g) 
 N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.温度不变同时充入Ar | D.降低温度同时增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,可逆反应:X(g) + 3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol?L-1、0.3 mol?L-1、0.08 mol?L-1,则下列判断不正确的是 ( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol?L-1、0.3 mol?L-1、0.08 mol?L-1,则下列判断不正确的是 ( )
| A.c1∶c2="=" 1∶3 | B.平衡时,Y和Z生成速率之比为3∶2 |
| C.X、Y的转化率不相等 | D.c1的取值范围为0< c1< 0.14 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某温度下,在容积固定的密闭容器中,发生可逆反应中A(g)+2B(g) 2Q(g)
2Q(g)
平衡时,各物质的浓度比为c(A):c(B):c(Q)=1:1:2,保持温度不变,以1:1:2的体积比再充入A、B、Q(相当加压),则下列叙述正确的是
A.刚充入时反应速率:v(正)减小,v(逆)增大
B.达到新的平衡时:反应混合物中A.B的体积分数增加
C. 达到新的平衡时:c(A):c(B):c(Q)仍为1:1:2
D. 达到新的平衡过程中:体系压强先增大,后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com