
| A、使用催化剂,v正、v逆都改变,变化的倍数相同 |
| B、升高温度,v正、v逆都增大,v正增大的倍数小于v逆增大的倍数 |
| C、增大压强,v正、v逆反应的速率都增大,v正增大的倍数大于v逆增大的倍数 |
| D、降低温度,v正、v逆都减小,v正减小的倍数大于v逆减小的倍数 |


科目:高中化学 来源: 题型:
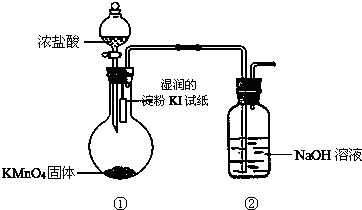
查看答案和解析>>
科目:高中化学 来源: 题型:
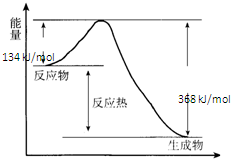 在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如图所示.
在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在多电子的原子里,能量高的电子通常在离核近的区域内活动 |
| B、任何元素的原子都是由核外电子和核内中子、质子组成的 |
| C、40 18Ar、40 19K、40 20Ca的质量数相同,所以它们是互为同位素 |
| D、核素指一种原子,而元素是指一类原子;核素间互称同位素,元素包含同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol S(g)与1 mol O2(g)的总能量比1 mol SO2(g)的总能量低QkJ |
| B、1个S(g)与1个O2(g)完全反应要放出Q kJ的热量 |
| C、S(s)+O2(g)?SO2(g)△H<-Q kJ?mol-1 |
| D、1 mol S(g)与1 mol O2(g)反应生成1 mol SO2(g)放出QkJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 碱 | 纯碱 | 烧碱 | 熟石灰 | 石灰石 |
| 盐 | Na2O | NH4Cl | Na2SO3 | NaOH |
| 电解质 | 浓盐酸 | 纯碱晶体 | 硫酸铜 | 铁 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、吸热反应一定需要加热才能完成 |
| B、反应条件中有加热的反应一定是吸热反应 |
| C、化学反应中的能量变化都为热量变化 |
| D、水煤气的制备反应是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com