
����Ŀ�����ӹ�ҵ����һ��Ũ�ȵ�FeCl3��Һ��ʴ����ͭ���ľ�Ե�壬�Ƴ�ӡˢ��·�塣�ֽ�һ�����ͭ���ľ�Ե��û��500mLijŨ��FeCl3��Һ�У�һ��ʱ�������·��ȡ������������Һ�м���һ���������ۣ���ַ�Ӧ���й���ʣ�ࣻ�������˳�������Һ��ȡ��20.00mL�������е���2.00mol/LAgNO3��Һ60.00 mLʱ����Һ�е�Cl-ǡ����ȫ��������ش������й����⣨���Է�Ӧǰ����Һ����ı仯����
��1��ԭFeCl3��Һ�����ʵ���Ũ��Ϊ_____________________��
��2������ʣ������������ۣ�������Һ�м����������������Ӧ������_______________________��
���𰸡� 2.00 mol��L-1 28.0g
����������1������Һ��ȡ��20.00mL�������е���2.00molL1AgNO3��Һ60.00mL����Һ�е�Clǡ����ȫ��������20ml��Һ��n(Cl)=n(Ag+)=2.00mol/L��0.060L=0.12mol������ԭ��Һ500ml��n(Cl)=0.12mol��![]() =3.00mol��n(FeCl3)=1.00 mol����ҺA��c(FeCl3)=
=3.00mol��n(FeCl3)=1.00 mol����ҺA��c(FeCl3)= ![]() ��
��
�ʴ�Ϊ��2.00mol/L��
��2��ͭ���Ⱥ�FeCl3��Ӧ������ͭ���ӣ��������������֮��ͭ�ֱ��û�������Ҳ����˵��Һ�����ֻ��FeCl2����Cl-�غ��֪��n(Cl-)=n(FeCl2)��2=3.00 mol��n(FeCl2)=1.50mol�����Լ���Fe�����ʵ���Ϊn(Fe)= n(FeCl2)- n(FeCl3)=1.5mol-1mol=0.50mol������Ϊ28.0g��
�ʴ�Ϊ��28.0g��


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������Cu��Cu2O��ɵĻ�Ϸ�ĩ���뵽125 mL 2.6 mol��L��1��������������ǡ����ȫ�ܽ�������ɫ��ҺX���ռ���V mL(��״��)�Ĵ�����ɫ����Y�����н�����ȷ����(����)
A. X������������
B. Yͨ�봿ˮ�еõ�������Һ
C. ԭ��Ϸ�ĩ��������С��7.8 g
D. ��V��1 680ʱ��ԭ��Ϸ�ĩ��Cu��Cu2O�����ʵ���֮��Ϊ8��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Na+Ũ��Ϊ1.0 molL-1��ij������Һ�У������ܺ���K+��Mg2+��Fe3+��Ba2+��CO32-��SO32-��SiO32-��Cl-��SO42-�����ӣ�ȡ����Һ100mL ������ͼ����ʵ�飨�����Լ�������������ȫ���ݳ���������˵������ȷ����

A. ԭ��Һ��һ��������Mg2+��Fe3+��Ba2+��SO42-
B. ��l00mLԭ��Һ�м�������BaCl2��Һ�����ٿ����ɳ���20.5g
C. Ϊȷ��ԭ��Һ���Ƿ���Cl-����ȡ��ҺC������AgNO3��ϡHNO3��Һ
D. ԭ��Һһ������K+��c(K+)����Ϊ1.5 molL-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʶ�����Ư�����ã�����Ư��ԭ��û���������ʻ�ѧ���ʵ���( )
A. �������� B. �������� C. ˫��ˮ D. ����̿
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij���淴ӦmA(g) + nB(g) ![]() qC(g)���ܱ������н��С���ͼ��ʾ��
qC(g)���ܱ������н��С���ͼ��ʾ��

����Ӧ�ڲ�ͬʱ��t ���¶�T��ѹǿP�뷴Ӧ��B����������Ĺ�ϵ���ߣ�
����ͼ����գ�
��1�����¶ȵĹ�ϵ��T1_____T2 ��������>������<������=������ͬ��
��2����ѹǿ�Ĺ�ϵ��P1_____P2 ��
��3������ѧ�������Ĺ�ϵ��m + n_____q ��
��4�����÷�Ӧ������ӦΪ__________��Ӧ��������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ĸ���ͬ�������н��кϳɰ��ķ�Ӧ��������������ͬʱ���ڲⶨ�Ľ��,�ж����ɰ�������������(����)
A. v(H2)=0.3 mol��L-1��min-1 B. v(N2)=0.05 mol��L-1��s-1
C. v(N2)=0.2 mol��L-1��min-1 D. v(NH3)=0.3 mol��L-1��min-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1273 Kʱ�������·�Ӧ��FeO(s) + CO(g) ![]() Fe(s) + CO2(g) K = 0.5
Fe(s) + CO2(g) K = 0.5
��1������д����˷�Ӧƽ�ⳣ��K����ѧ����ʽ��K=_____________________��
��2�������CO��CO2����ʼŨ��Ϊ������ֵ��c (CO) = 0.05 mol��L--1 ��c (CO2) = 0.01 mol��L--1 �������ǵ�ƽ��Ũ��_________����д��������̣�
��3����ƽ��ʱ����CO��ת����Ϊ________________������д������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Fe2����I����Br������Һ��ͨ���������������Һ���������ӵ����ʵ����仯��ͼ��ʾ����֪b��a��5���߶�����ʾһ�ֺ����ᣬ����������ʾ�������к�����ͬ��Ԫ�ء�����˵����ȷ����(����)
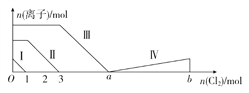
A. �߶�����ʾBr���ı仯��� B. �߶�����ʾIO3���ı仯���
C. ����ͼ��������a��ֵ D. ԭ��Һ��n(FeI2)��n(FeBr2)��3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeSO4��7H2O������Ȼˮ������������Ҫ����pHΪ9���ҵ���Ҫԭ����( )
A.Fe2���ڼ����������ױ�������Fe3��
B.FeSO4��7H2O����ˮ��������
C.FeSO4��7H2O����ˮ���Լ���
D.���϶�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com