
【题目】在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是( )
A. v(H2)=0.3 mol·L-1·min-1 B. v(N2)=0.05 mol·L-1·s-1
C. v(N2)=0.2 mol·L-1·min-1 D. v(NH3)=0.3 mol·L-1·min-1
科目:高中化学 来源: 题型:
【题目】电解饱和食盐水时两电极上产生气体的体积比应是1∶1,但实际测量时却发现V(H2)>V(Cl2)(常温常压),其原因可能是( )
A.H2的摩尔质量比Cl2的小
B.Cl2有刺激性气味
C.H2的熔沸点比Cl2的低
D.H2的溶解度比Cl2的小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯碱工业中,原料盐中的杂质离子危害很高,能破坏离子膜,以下对Ca2+、Mg2+、Fe3+、SO42-除去顺序不合理的是 ( )
A.BaCl2、NaOH、Na2CO3
B.BaCl2、Na2CO3、NaOH
C.NaOH、BaCl2、Na2CO3
D.Na2CO3、BaCl2、NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷与氯气在光照条件下发生反应(装置如图),实验现象及解释均正确的是( )
现象 | 解释 | |
A. | 量筒内气体颜色逐渐变浅 | 甲烷被氯气还原 |
B. | 量筒内出现少量白雾 | 生成HCl气体 |
C. | 量筒内壁产生油状液滴 | 油状液体是CCl4 |
D. | 量筒中液面降低 | 生成液态产物 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。现将一块敷有铜箔的绝缘板没入500mL某浓度FeCl3溶液中,一段时间后,将该线路板取出,向所得溶液中加入一定量的铁粉,充分反应后有固体剩余;将固体滤出并从滤液中取出20.00mL,向其中滴入2.00mol/LAgNO3溶液60.00 mL时,溶液中的Cl-恰好完全沉淀。请回答下列有关问题(忽略反应前后溶液体积的变化):
(1)原FeCl3溶液的物质的量浓度为_____________________。
(2)假若剩余固体中有铁粉,则向溶液中加入的铁粉质量至少应当大于_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. Na2O2分子中所有原子最外层均达到8电子稳定结构
B. NH4Cl、MgCl2均为离子化合物,均含有离子键和共价键
C. 同周期第ⅠA族元素和第ⅦA族元素之间只能形成离子化合物
D. NH4Cl仅由非金属元素组成,所以它是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是医药上常用的一种药剂,合成路线如图所示。其中A是相对分子质量为58的链状烃,其核磁共振氢谱上的峰面积之比为9:1,G为五元环状有机化合物。
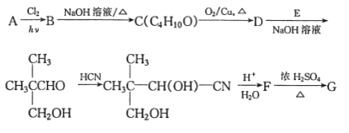
已知:①R'-CH2-CHO+RCH2-CHO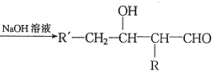
②RCN在酸性条件下水解变成RCOOH
(1)D分子中含有的官能团名称是___________。
(2)B→D反应过程中涉及的反应类型有_______________。
(3)A的结构简式为___________;E的结构简式为______________。
(4)F→G的化学方程式为____________。F能发生缩聚反应,则生成链节的主链上有四个碳愿子的高分子化合物的结构简式为_____________。
(5)同时满足下列条件G的同分异构体有_______种。(不包括立体异构)
①能发生银镜反应; ②能与NaHCO3发生反应。
其中核磁共振氢谱为4组峰的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①甲醛(HCHO)与葡萄糖化学性质相似,都具有还原性。②甲酸钙易溶于水。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下实验。
(1)在右图装置中进行实验,向a中加入0.5 mol·L-1CuSO4溶液50 mL和5 mol·L-1NaOH溶液100 mL,振荡,再加入40%的甲醛溶液50 mL,缓慢加热20分钟后冷却至室温。
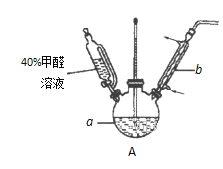
①仪器a的名称是_____________;
②能说明甲醛具有还原性的实验现象是______________。
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分,将装置A和如下图所示装置连接后进行实验。
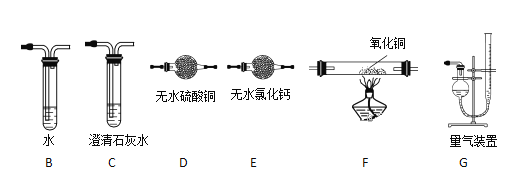
依次连接的合理顺序为A→B→___→____→____→____→G,装置B的作用是_________。有H2的实验现象是_________________________。
(3)已知HCHO![]() HCOOH
HCOOH![]() H2CO3。设计实验证明a中甲醛中的碳元素未被氧化成+4价。写出实验操作、现象、结论______________________。
H2CO3。设计实验证明a中甲醛中的碳元素未被氧化成+4价。写出实验操作、现象、结论______________________。
(4)反应后a中有红色固体产生,为探究其组成,提出如下假设:
假设一:只有Cu2O。 假设二:只有Cu。
假设三:Cu2O和CuO 假设四:________________________ ;
假设_______明显不成立,理由是___________________________ 。
进行如下实验(以下每步均充分反应):

已知:Cu2O ![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
①锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为____________________;
②将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeCO3,其流程如下:

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:FeS2 + 14Fe3+ + 8H2O =15Fe2+ + 2SO42— + 16H+
下列说法不正确的是
A. “还原”后可以用KSCN检验Fe3+是否反应完全
B. “还原”时反应Ⅱ的离子方程式为2Fe3+ + FeS2 = 2S↓+ 3Fe2+
C. “沉淀”时,可以先将溶液调节成强碱性,再加入(NH4)2CO3
D. 所得FeCO3需充分洗涤,可以用稀盐酸和BaCl2溶液检验FeCO3是否已洗涤干净
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com