
【题目】向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是( )
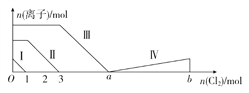
A. 线段Ⅱ表示Br-的变化情况 B. 线段Ⅳ表示IO3-的变化情况
C. 根据图象无法计算a的值 D. 原溶液中n(FeI2)∶n(FeBr2)=3∶1
【答案】B
【解析】向含Fe2+、I-、Br-的溶液中通入过量的氯气,还原性I->Fe2+>Br-,首先发生反应碘离子和氯气反应生成碘单质和氯离子,再发生氯气和亚铁离子反应生成铁离子和氯离子,最后氯气和溴离子反应生成溴单质和氯离子,所以线段Ⅰ代表了碘离子的变化,线段Ⅱ代表了亚铁离子的变化,线段Ⅲ代表了溴离子的变化。由通入氯气可知,根据反应分析,溶液中的碘离子物质的量为2摩尔,溶液中的亚铁离子为4摩尔,亚铁离子反应完,根据电荷守恒分析,溴离子为6摩尔。A.根据分析,线段Ⅱ代表了亚铁离子的变化,故错误;B. 线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素,则该元素为碘元素,已知碘单质的物质的量为2摩尔,反应消耗氯气的物质的量为5mol,根据电子守恒,该含氧酸中碘元素的化合价为5价,则该含氧酸为碘酸,HIO3,及该线段表示IO3-的变化,故正确;C.由分析可知,溶液中溴离子为6摩尔,根据反应分析,溴离子需要的氯气的物质的量为3摩尔,则a=3+3=6mol,故错误;D. 原溶液中n(FeI2)∶n(FeBr2)= n(I-)∶n(Br-)=2:6=1:3,故错误。
故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是 ( )
A. Mg B. Cu C. Ag D. H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。现将一块敷有铜箔的绝缘板没入500mL某浓度FeCl3溶液中,一段时间后,将该线路板取出,向所得溶液中加入一定量的铁粉,充分反应后有固体剩余;将固体滤出并从滤液中取出20.00mL,向其中滴入2.00mol/LAgNO3溶液60.00 mL时,溶液中的Cl-恰好完全沉淀。请回答下列有关问题(忽略反应前后溶液体积的变化):
(1)原FeCl3溶液的物质的量浓度为_____________________。
(2)假若剩余固体中有铁粉,则向溶液中加入的铁粉质量至少应当大于_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是医药上常用的一种药剂,合成路线如图所示。其中A是相对分子质量为58的链状烃,其核磁共振氢谱上的峰面积之比为9:1,G为五元环状有机化合物。
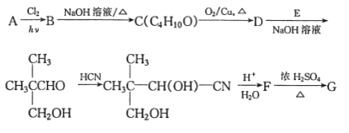
已知:①R'-CH2-CHO+RCH2-CHO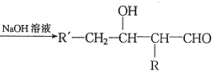
②RCN在酸性条件下水解变成RCOOH
(1)D分子中含有的官能团名称是___________。
(2)B→D反应过程中涉及的反应类型有_______________。
(3)A的结构简式为___________;E的结构简式为______________。
(4)F→G的化学方程式为____________。F能发生缩聚反应,则生成链节的主链上有四个碳愿子的高分子化合物的结构简式为_____________。
(5)同时满足下列条件G的同分异构体有_______种。(不包括立体异构)
①能发生银镜反应; ②能与NaHCO3发生反应。
其中核磁共振氢谱为4组峰的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用下图所示装置电解,其中某电极增重ag,另一电极上产生标准状况下的气体VmL。下列说法正确的是

A. 铜电极连接电源正极 B. 铜的相对原子质量的计算式是![]()
C. 黑色粉末X是铁粉 D. 石墨电极上发生的反应是4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①甲醛(HCHO)与葡萄糖化学性质相似,都具有还原性。②甲酸钙易溶于水。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下实验。
(1)在右图装置中进行实验,向a中加入0.5 mol·L-1CuSO4溶液50 mL和5 mol·L-1NaOH溶液100 mL,振荡,再加入40%的甲醛溶液50 mL,缓慢加热20分钟后冷却至室温。
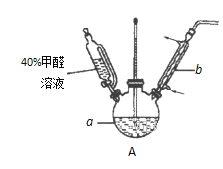
①仪器a的名称是_____________;
②能说明甲醛具有还原性的实验现象是______________。
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分,将装置A和如下图所示装置连接后进行实验。
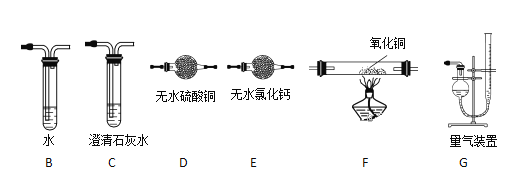
依次连接的合理顺序为A→B→___→____→____→____→G,装置B的作用是_________。有H2的实验现象是_________________________。
(3)已知HCHO![]() HCOOH
HCOOH![]() H2CO3。设计实验证明a中甲醛中的碳元素未被氧化成+4价。写出实验操作、现象、结论______________________。
H2CO3。设计实验证明a中甲醛中的碳元素未被氧化成+4价。写出实验操作、现象、结论______________________。
(4)反应后a中有红色固体产生,为探究其组成,提出如下假设:
假设一:只有Cu2O。 假设二:只有Cu。
假设三:Cu2O和CuO 假设四:________________________ ;
假设_______明显不成立,理由是___________________________ 。
进行如下实验(以下每步均充分反应):

已知:Cu2O ![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
①锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为____________________;
②将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O ![]() H++OH-;ΔH > 0,下列叙述正确的是( )
H++OH-;ΔH > 0,下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中通入HCI气体,pH值减小,KW不变
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)增大
D. 将水加热,KW增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活、环境保护、资源利用、能源开发等密切相关。下列说法错误的是
A.煤炭经气化、液化和干馏等过程,可以转化为清洁能源
B.利用二氧化碳制造全降解塑料,可以缓解温室效应
C.利用生物方法脱除生活污水中的氮和磷,防止水体富营养化
D.高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图像能直观地反映有关物理量的变化及规律,下列各图像与描述相符的是

A. 图1表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图2表示0.lmolMgCl2·6H2O在空气中充分加热时固体质量随时间的变化
C. 图3表示分别稀释10 mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>l00
D. 图4表示平衡2NO2(g)![]() N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com