
【题目】25 ℃时,水的电离达到平衡:H2O ![]() H++OH-;ΔH > 0,下列叙述正确的是( )
H++OH-;ΔH > 0,下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中通入HCI气体,pH值减小,KW不变
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)增大
D. 将水加热,KW增大,pH不变
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】在Na+浓度为1.0 molL-1的某澄清溶液中,还可能含有K+、Mg2+、Fe3+、Ba2+、CO32-、SO32-、SiO32-、Cl-、SO42-等离子,取该溶液100mL 进行下图连续实验(所加试剂均过量,气体全部逸出)。下列说法不正确的是

A. 原溶液中一定不存在Mg2+、Fe3+、Ba2+、SO42-
B. 在l00mL原溶液中加入足量BaCl2溶液,至少可生成沉淀20.5g
C. 为确定原溶液中是否含有Cl-,可取滤液C,加入AgNO3和稀HNO3溶液
D. 原溶液一定存在K+,c(K+)可能为1.5 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1273 K时,有如下反应:FeO(s) + CO(g) ![]() Fe(s) + CO2(g) K = 0.5
Fe(s) + CO2(g) K = 0.5
(1)、请写出求此反应平衡常数K的数学表达式:K=_____________________。
(2)、如果CO和CO2的起始浓度为下列数值:c (CO) = 0.05 mol·L--1 ,c (CO2) = 0.01 mol·L--1 ,求它们的平衡浓度_________。(写出计算过程)
(3)、平衡时,求CO的转化率为________________(不用写计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是( )
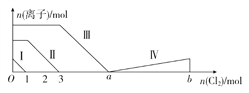
A. 线段Ⅱ表示Br-的变化情况 B. 线段Ⅳ表示IO3-的变化情况
C. 根据图象无法计算a的值 D. 原溶液中n(FeI2)∶n(FeBr2)=3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,对于可逆反应:A(s)+2B(g) ![]() C(g)+2D(g) ΔH > 0,则下列叙述正确的是( )
C(g)+2D(g) ΔH > 0,则下列叙述正确的是( )
A. 其他条件不变时,增加A的量平衡向正向进行
B. 该反应的平衡常数表达式为: ![]()
C. 升高温度时,该反应的平衡常数增大
D. 减小反应物A的浓度,该反应的平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的说法正确的是
A.玻璃、陶瓷、水泥、光导纤维的化学组成都是硅酸盐
B.液氨汽化时要吸收大量的热,可用作制冷剂
C.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
D.生石灰能与水反应,可用来干燥氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 H2 和钠反应制备氢化钠的装置如右图所示(Zn 粒中含有少量 ZnS 杂质),下列说法不正确的是

A. ①、 ②中依次盛有浓 NaOH 溶液、 浓 H2SO4
B. 管式炉加热前, 用试管收集③处气体并点燃, 通过声音判断气体纯度
C. 结束反应时, 先停止管式炉加热, 再关闭活塞 K
D. 取出瓷舟内的固体, 投入适量水中, 若有气体产生, 即可证明制得了氢化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4·7H2O用作天然水净化混凝剂,要调到pH为9左右的主要原因是( )
A.Fe2+在碱性条件下易被氧化成Fe3+
B.FeSO4·7H2O溶于水后显酸性
C.FeSO4·7H2O溶于水后显碱性
D.以上都不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室合成了一种可溶的金属氯化物(RClx),为了测定该金属氯化物的成分,研究人员做了以下实验:取物质的量浓度为0.05molL﹣1的金属氯化物(RClx) 溶液20mL,使之恰好与20mL 0.15molL﹣1的AgNO3溶液完全反应.则该氯化物的化学式为( )
A.RCl
B.RCl2
C.RCl3
D.RCl4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com