
许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1)重晶石(BaSO4)常做胃肠道造影剂。已知:常温下,Ksp(BaSO4)=1.1×10-10。向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)= ;
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]常做分析剂。等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 b.NH4HSO4 c.(NH4)2SO4 d.(NH4)2SO3
其中c(NH4+)由大到小的顺序为 (填选项字母);
(3)过二硫酸钾(K2S2O8)常做强氧化剂,Na2S2O3常做还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为 ;
②样品中K2S2O8的含量可用碘量法测定。操作步骤为称取0.3000 g样品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以 为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-= 2I-+S4O62-)。重复2次,测得平均消耗标准液21.00 mL。该样品中K2S2O8的质量分数为(杂质不参加反应) _(结果保留三位有效数字)。
(1)2.2×10-8mol/L( 未写单位不得分) (2)a>c>d>b
(2)①5S2O32-+2Mn2++8H2O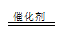 10SO42-+2MnO4-+16H+ (没写反应条件给分)
10SO42-+2MnO4-+16H+ (没写反应条件给分)
②淀粉 94.5%
解析试题分析:(1)Ksp(BaSO4)=1.1×10-10,当溶液的pH=2时,c(SO42-) ="0.005" mol/L ,c(Ba2+)= Ksp(BaSO4)/ c(SO42-)=2.2×10-8mol/L ;
(2)等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 ,c.(NH4)2SO4 ,d.(NH4)2SO3 中NH4+浓度大于b.NH4HSO4 ,a.Fe2+和NH4+水解相互抑制,d. NH4+和SO32-水解相互促进。所以c(NH4+)由大到小的顺序为a>c>d>b;
(3)过二硫酸钾(K2S2O8)常做强氧化剂,①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,Mn2+被氧化成MnO4-,S2O82-被还原,5S2O32-+2Mn2++8H2O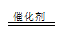 10SO42-+2MnO4-+16H+,②因为该反应涉及I2,可以用淀粉溶液作指示剂;由I2+2S2O32-= 2I-+S4O62-得关系: n(S2O82-)--2n(S2O32-);已知n(S2O32-)=2.1×10-3mol; 求得n(S2O82-)=1.05×10-3mol;w(K2S2O8)=270g/mol×1.05×10-3mol /0.3g×100℅=94.5%
10SO42-+2MnO4-+16H+,②因为该反应涉及I2,可以用淀粉溶液作指示剂;由I2+2S2O32-= 2I-+S4O62-得关系: n(S2O82-)--2n(S2O32-);已知n(S2O32-)=2.1×10-3mol; 求得n(S2O82-)=1.05×10-3mol;w(K2S2O8)=270g/mol×1.05×10-3mol /0.3g×100℅=94.5%
考点:溶度积常数的计算及氧化还原反应的分析和计算


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:填空题
(创新预测题)(1)①在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,这是因为________,离子方程式为__________________________。
②在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠碱性溶液,发现蓝色逐渐消失,这是因为______________________________。离子方程式是_______________________________。
③对比①和②实验所得的结果,将I2、ClO-、SO42—性由强到弱的顺序排列为_____________________________。
(2)今有铁片、铜片,设计实验证明以下事实,并写出反应的化学方程式。
①浓硫酸的氧化性比稀硫酸强。________________________________。
②氯化铁溶液中Fe3+的氧化性比硫酸铜溶液中的Cu2+强。__________________________。
③铁的还原性比铜强。
___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
综合利用转炉煤气[CO(60~80%)、CO2(15~20%)及微量N2等]和硫酸工业尾气中的SO2,既能净化尾气,又能获得保险粉(Na2S2O4),其部分工艺流程如下: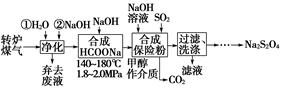
(1)转炉炼钢时,存在反应:Fe3C(s)+CO2(g)??2CO(g)+3Fe(s),其平衡常数表达式为K=________。
(2)煤气净化时,先用水洗再用NaOH溶液洗涤,其目的是________。
(3)从滤液中回收甲醇的操作方法是____________________________;
还可回收的盐类物质是______________________________________(只写一种化学式)。
(4)合成保险粉反应的化学方程式为_________________________。
(5)保险粉、H2O2均可用于纸浆漂白,写出保险粉与过量的H2O2,在水溶液中反应生成硫酸盐等物质的离子方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有五种可溶性物质A、B、C、D、E,它们所含阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3—、CO32—、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是________和________(填化学式)。
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质记为C,当C与B溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕黄色沉淀,向该沉淀中滴入稀硝酸沉淀部分溶解,最后留有白色沉淀不再溶解。则X为________。
A.SO32— B.SO42— C.CH3COO- D.SiO32—
(3)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的________(填相应的离子符号)。有关反应的离子方程式为___________________。
(4)利用上述已经确定的物质,可以检验出D、E中的阳离子,请简述实验操作步骤、现象及结论:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、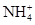 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、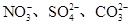 。已知:
。已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
回答下列问题:
(1)五种盐中,一定没有的阳离子是_________________________________________________;
所含的阴离子相同的两种盐的化学式是_____________________________________________。
(2)D的化学式为_________,D溶液显碱性的原因是(用离子方程式表示)________________。
(3)A和C的溶液反应的离子方程式是______________________________________________。
E和氨水反应的离子方程式是______________________________________________________。
(4)若要检验B中所含的阳离子,正确的实验方法是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
进行污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生络合反应:Cu2++2H2Dz Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式 ,
萃取Fe3+的过程中要控制适宜的酸度,如果溶液的pH过大,其后果是 。
(2)如图是用双硫腙(H2Dz)~CCl4络合萃取某些金属离子的酸度曲线,它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式萃取分离的百分率。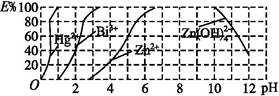
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~CCl4络合萃取法处理废水。
①欲完全将废水中的Hg2+分离出来,须控制溶液的pH= 。
②当调节pH=2时,铋(Bi)的存在形式有 ,其物质的量之比为 。
③萃取到CCl4中的Zn(HDz)2分液后,加入足量NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式:
(3)污水中的亚汞离子(H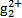 )必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化H
)必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化H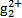 生成硫酸汞,写出该反应的化学方程式: 。
生成硫酸汞,写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
溴及其化合物广泛应用在有机合成、化学分析等领域。
(1)海水提溴过程中溴元素的变化如下: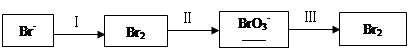
①过程Ⅰ,海水显碱性,调其pH<3.5后,再通入氯气。
ⅰ.通入氯气后,反应的离子方程式是______。
ⅱ.调海水pH可提高Cl2的利用率,用平衡原理解释其原因是______。
②过程Ⅱ,用热空气将溴赶出,再用浓碳酸钠溶液吸收。完成并配平下列方程式。
Br2+ Na2CO3=
Na2CO3= NaBrO3+
NaBrO3+ CO2+
CO2+ ______
______
③过程Ⅲ,用硫酸酸化可得Br2和Na2SO4的混合溶液。
相同条件下,若用盐酸酸化,则所得溴的质量减少,原因是______。
(2)NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6 mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
| 粒子 | I2 | Br2 | IO3- |
| 物质的量/mol | 0.5 | 1.3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有下列物质:①NaCl晶体;②液态SO2;③纯醋酸;④硫酸钡 ;⑤铜;⑥酒精(C2H5OH);⑦熔化的KCl;⑧NaOH溶液。
请用以上物质回答下列问题。(填序号)
(1)在上述状态下能导电的物质是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质,但溶于水后的水溶液能导电的是 ;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按图的装置连接好仪器,先在烧杯中加入20mL左右的Ba(OH)2溶液,接通电源后,逐渐滴加稀硫酸至过量。
(1)当逐渐滴加稀硫酸时,烧杯中观察到的现象是: 。
(2)灯泡的现象是: ;原因是: 。
(3)发生反应的离子方程式为:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com