
综合利用转炉煤气[CO(60~80%)、CO2(15~20%)及微量N2等]和硫酸工业尾气中的SO2,既能净化尾气,又能获得保险粉(Na2S2O4),其部分工艺流程如下: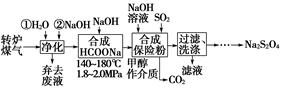
(1)转炉炼钢时,存在反应:Fe3C(s)+CO2(g)??2CO(g)+3Fe(s),其平衡常数表达式为K=________。
(2)煤气净化时,先用水洗再用NaOH溶液洗涤,其目的是________。
(3)从滤液中回收甲醇的操作方法是____________________________;
还可回收的盐类物质是______________________________________(只写一种化学式)。
(4)合成保险粉反应的化学方程式为_________________________。
(5)保险粉、H2O2均可用于纸浆漂白,写出保险粉与过量的H2O2,在水溶液中反应生成硫酸盐等物质的离子方程式:________________________________。
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:填空题
六种短周期元素,aA、bB、cC、dD、eE、fF,已知原子序数大小关系是:a<e<c<b<f<d,且a+b=(c+d)/2;六种元素在周期表中的位置关系是:A、B同主族,C、D也同主族;C、E相邻,B、F也相邻。
(1)B、C、D三种元素形成的六原子核的化合物和水反应的离子方程式是: 。
(2)A、C形成的四原子核化合物甲的电子式为 ,该化合物呈弱酸性,试写出这种化合物的电离方程式: 。
(3)写出分别由A、B、C、D四种元素所形成的两种化合物的水溶液相互反应的离子方程式: 。
(4)写出A、C、D形成的六原子核化合物乙的水溶液和甲的水溶液反应的化学方程式: 。
(5)写出E和F形成的化合物和化合物A2C反应的化学方程式: 。
(6)A、E形成的四原子核化合物丙容易液化,其原因是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 | Cl- CO32— NO3— SO42— I- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚铁是血红蛋白重要组成成分,起着向人体组织传送O2的作用,如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害。下面是一种常见补药品说明书中的部分内容:该药品含Fe2+33%~36%,不溶于水但能溶于人体中的胃酸:与Vc(维生素C)同服可增加本品吸收。
(一)甲同学设计了以下下实验检测该补铁药品中是否含有Fe2+并探究Vc的作用:
(1)加入新制氯水后溶液中发生的离子反应方程式是_________________________、
Fe3+ +SCN-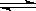 [Fe(SCN) ]2+。
[Fe(SCN) ]2+。
(2)加入KSCN溶液后溶液变为淡红色,说明溶液中有少量Fe3+。该离子存在的原因可能是(填编号)_____________________。
A.药品中的铁本来就应该以三价铁的形式存在
B.在制药过程中生成少量三价铁
C.药品储存过程中有少量三价铁生成
(3)药品说明书中“与Vc同服可增加本品吸收”请说明理由_______________________。
(二)乙同学采用在酸性条件下用高锰酸钾标准溶液滴定的方法测定该药品是否合格,反应原理为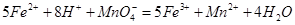 。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
(4)该实验中的试剂2与甲同学设计的实验中的试剂1都可以是______(填序号)。
A.蒸馏水B.稀盐酸C.稀硫酸D.稀硝酸
(5)本实验滴定过程中操作滴定管的图示正确的是_______(填编号)。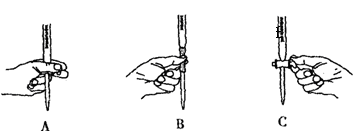
(6)请通过计算,说明该药品含“铁”量是否合格(写出主要计算过程)?
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
1 L某混合溶液,可能含有的离子如下表。
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32—、AlO2— |
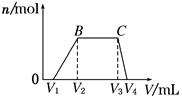
| Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2 L |
| n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
| n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前,_______ 和_______是主要的去离子方法。
(2)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。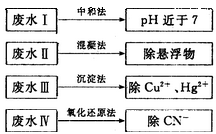
①废水I若采用CO2处理,离子方程式是_______。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO3-)越大,净水效果越好,这是因为________。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++_______=CH3Hg++H+。我国规定,Hg2+的排放标准不能超过0. 05 mg/L。若某工厂排放的废水1L中含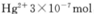 ,是否达到了排放标准_______(填“是”或“否”)。
,是否达到了排放标准_______(填“是”或“否”)。
④废水Ⅳ常用Cl2氧化CN-成CO2和N2。,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为____________
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行________处理。把进行过离子交换的CaR2(或MgR2)型树脂置于_______中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,如图是海水中利用电渗析法获得淡水的原理图,已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请回答: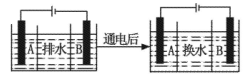
①阳离子交换膜是指____(填“A”或“B”)。②写出通电后阳极区的电极反应式____。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)生产生活中广泛涉及氧化还原反应。
(1)工业上冶炼下列物质通常不采用电解法的是 。
a.Na b.Mg c.Fe d.Ag
(2)下图为电解精炼铜的示意图,电极a为粗铜,则a连接电源的 极,b极的电极反应式为 。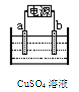
(3)汽车剧烈碰撞时,安全气囊中发生反应NaN3 + KNO3 → K2O + Na2O + X↑(未配平),已知X为单质,在反应中NaN3失去电子。则该反应的氧化剂为 ,X的化学式为 ,该反应的氧化剂和还原剂的物质的量之比为 。
(4)工业上制取高纯度MnO2的某一步骤如图所示,请写出该反应的离子方程式 。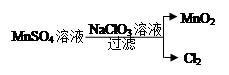
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1)重晶石(BaSO4)常做胃肠道造影剂。已知:常温下,Ksp(BaSO4)=1.1×10-10。向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)= ;
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]常做分析剂。等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 b.NH4HSO4 c.(NH4)2SO4 d.(NH4)2SO3
其中c(NH4+)由大到小的顺序为 (填选项字母);
(3)过二硫酸钾(K2S2O8)常做强氧化剂,Na2S2O3常做还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为 ;
②样品中K2S2O8的含量可用碘量法测定。操作步骤为称取0.3000 g样品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以 为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-= 2I-+S4O62-)。重复2次,测得平均消耗标准液21.00 mL。该样品中K2S2O8的质量分数为(杂质不参加反应) _(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种。现进行如下实验:
(1)取少量固体粉末加到足量水中,得到白色沉淀,上层为无色清液。
(2)继续往其中加入足量稀硝酸,白色沉淀完全消失,并有气泡产生。
(3)取少量⑵中的溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶。
根据上述实验现象判断:该白色固体中一定含有__________________,一定不含有________,可能含有_____________。
如何验证可能存在的物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com