
【题目】室温下,向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.再加入10 mL pH=11的NaOH溶液,混合液的pH=7
C.醋酸的电离程度增大,c(H+)亦增大
D.溶液中![]() 不变
不变
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中正确的是( )
A.稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
B.硫酸铝溶液与过量的氨水反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
C.苯酚钠的水溶液中通入少量的CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
D.醋酸钠的水解反应:CH3COO-+H3O+=CH3COOH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分子中有10个氢原子的烷烃的分子式是________________________________。
(2)已知下列三种有机物:
A.苯 B.乙醇 C.乙酸
回答下列问题
①写出苯的结构简式____________;
②能使紫色石蕊溶液变红的是____________(填字母代号);
③医疗上常用体积分数为75%的____________(填字母代号)作消毒剂;
④写出选取上述两种有机物在浓硫酸和加热条件下反应制备乙酸乙酯的化学方程式________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.增大压强使平衡向生成Z的方向移动,平衡常数增大
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.反应达平衡时,X的转化率为50%
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性废液含有H+、Fe3+、Ni2+、NO3—、F-和Cr2O72-等。下图是该废液的综合利用工艺流程:(假设: F—与金属离子的络合反应不影响其它反应和计算)
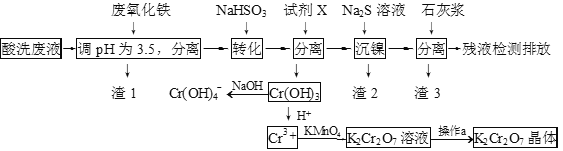
已知:金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+([Ni(NH3)6]2+为难电离的络合离子)
[Ni(NH3)6]2+([Ni(NH3)6]2+为难电离的络合离子)
(1)滤渣1的主要成分为:____________。
(2)试剂X可以是足量氨水,还可以是:____________ 。(填序号)
A.Ni(OH)2 B.Cr2O3 C.Fe2O3 D.NaOH
(3)若试剂X是足量氨水,“沉镍”的离子方程式为:____________。
(4)经检测,最后的残液中c(Ca2+)=1.0×10─5 molL-1,则残液中F-浓度____________(填 “符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10 mgL─1]。
(5)镍(Ni)及其化合物广泛应用于生产电池、电镀和催化剂等领域。
①某蓄电池反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2,放电时若外电路中转移0.6mol电子则正极增重____g。
Fe(OH)2+Ni(OH)2,放电时若外电路中转移0.6mol电子则正极增重____g。
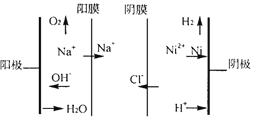
②图为双膜三室电解法处理含镍废水回收金属镍的原理示意图,阳极的电极反应式为____;电解过程中,需要控制溶液pH值为4左右,原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1molL-1的(NH4)2SO4溶液,用离子方程式表示该溶液显酸性的原因:___,在该溶液中各种离子浓度由大到小的顺序为___。
(2)B为0.1molL-1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:__(用离子方程式和必要的文字说明)。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入__,目的是___;若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15.66g镁铝合金加入到800mL稀硝酸中,恰好完全反应(假设反应中还原产物只有NO),向所得溶液中加入足量的3mol·L-1NaOH溶液,测得生成沉淀的质量与原合金的质量相等,则下列有关叙述不正确的是
A. 原稀硝酸的浓度为2.6mol·L-1 B. 生成NO的体积为11.648L(标准状况)
C. 反应过程中共消耗1.56molNaOH D. 合金中Al的质量分数约为58.6%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温常压下,l mol乙醇完全燃烧生成气态二氧化碳和液态水时,放出1367kJ的热量,写出该反应的热化学方程式________________________。
(2)在一定条件下,向密闭容器中充入一定量的NO2气体,发生如下的反应:![]() △H<0,达到平衡后,欲使混合气体颜色加深,可采取的措施是____________(填字母代号)
△H<0,达到平衡后,欲使混合气体颜色加深,可采取的措施是____________(填字母代号)
A.加热 B.压缩容器体积 C.加催化剂
(3)写出可逆反应![]() 的平衡常数表达式K=____________。
的平衡常数表达式K=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+3B2(g)![]() 2AB3(g) ΔH<0,相关数据如下表所示:
2AB3(g) ΔH<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1mol A2、3molB2 | 2molAB3 | 2mol AB3 |
反应物的转化率 | a甲 | a乙 | a丙 |
反应的平衡常数K= | K甲 | K乙 | K丙 |
平衡时AB3的浓度/mol·L-1 | c甲 | c乙 | c丙 |
平衡时AB3的反应速率/mol·L-1·min-1 | v甲 | v乙 | v丙 |
下列说法正确的是
A. v甲=v丙 B. c乙< c丙 C. a甲 +a乙<1 D. K乙≤K丙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com