
【题目】如图是某课外小组制取乙炔并测定乙炔的某些性质的实验. 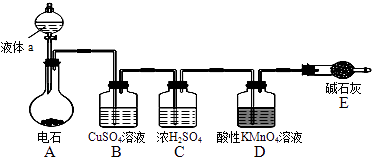
(1)写出实验室制取乙炔的化学方程式: .
(2)实验室制取乙炔时,分液漏斗中的液体a通常是 .
(3)CuSO4溶液的作用是 .
(4)装置D中的现象是: .
(5)工业上常用乙炔、饱和食盐水等物质作原料来合成聚氯乙烯,请写出相关方程式:
; ; ; .
【答案】
(1)CaC2+2H2O→Ca(OH)2+C2H2↑
(2)饱和食盐水
(3)吸收杂质气体硫化氢
(4)高锰酸钾溶液褪色
(5)2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑| Cl2+H2=2HCl| C2H2+HCl→CH2=CHCl| nCH2=CHCl→
2NaOH+Cl2↑+H2↑| Cl2+H2=2HCl| C2H2+HCl→CH2=CHCl| nCH2=CHCl→![]()
【解析】解:(1.)电石与水反应生成乙炔和氢氧化钙,化学反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑,所以答案是:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2.)电石与水反应速率太快,通常利用饱和食盐水代替水以减慢化学反应速率,所以答案是:饱和食盐水;
(3.)此反应中会产生杂质气体,硫化氢、磷化氢,会对乙炔性质实验造成干扰,利用硫酸铜溶液吸收硫化氢气体,以避免干扰,所以答案是:吸收杂质气体硫化氢;
(4.)乙炔含有碳碳三键,能与高锰酸钾溶液反应使其褪色,所以答案是:高锰酸钾溶液褪色;
(5.)聚氯乙烯的单体是氯乙烯,饱和食盐水的作用是电解制取氯气,化学反应方程式为:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑,Cl2+H2=2HCl,C2H2+HCl→CH2=CHCl,氯乙烯加聚反应生成聚氯乙烯:nCH2=CHCl→
2NaOH+Cl2↑+H2↑,Cl2+H2=2HCl,C2H2+HCl→CH2=CHCl,氯乙烯加聚反应生成聚氯乙烯:nCH2=CHCl→![]() , 所以答案是:2NaCl+2H2O
, 所以答案是:2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑、Cl2+H2=2HCl、C2H2+HCl→CH2=CHCl、nCH2=CHCl→
2NaOH+Cl2↑+H2↑、Cl2+H2=2HCl、C2H2+HCl→CH2=CHCl、nCH2=CHCl→![]() .
.


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:

已知:反应Ⅱ包含2NaHSO3![]() Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式:__________________。
(2)反应I的化学方程式为________________________。
(3)“灼烧”时发生反应的化学方程式:______________。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为__________________。
(5)副产品X的化学式是____________。
(6)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH= 2K2CO3+6H2O
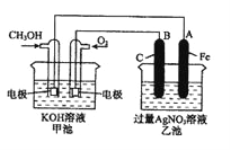
(1)乙池是__________装置。
(2)通入CH3OH的电极名称是______________________
(3)通入O2的电极的电极反应式是__________________________。若甲池用熔融碳酸盐为电解质,则通入O2的电极的电极反应式为___________________。
(4)乙池中反应的化学方程式为_______________________________。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2_________mL(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 同温同压下H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件的ΔH都相同
B. 已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为-241.8kJ/mol
C. 在稀溶液中H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 molH2SO4的浓硫酸与含1 molNaOH的稀溶液混合,放出的热量为57.3 kJ
D. 由N2O4(g) ![]() 2NO2(g) △H=-56.9 kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
2NO2(g) △H=-56.9 kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物的研究在无机化学的发展中占有独特的地位。
(1)硼元素有10B和11B两种天然稳定同位素,在基态11B原子中,价电子中存在______对自旋方向相反的电子。第一电离能介于B与N之间的第二周期元素有______种。
(2)目前已制得二十多种硼氢化合物,如乙硼烷B2H6、丁硼烷B4H10等在能源方面前景可期。
①NH3能通过配位键与硼元素的某种氢化物作用得到化合物M, M是一种新的储氢材料,加热M 会缓慢释放出H2,并转化为化合物N, M、N分别是乙烷、乙烯的等电子体。M的结构式为______须标出配位键),氮原子在M、N分子中的杂化方式分别为_________。
②B2H6可作火箭燃料,将B2H6气体通入H2O中的反应为B2H6+6H20=2H3BO3+6H2↑,据此可判断反应中所涉及元素的电负性从小到顺序为_________。
③以硼酸(H3BO3)为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,可将竣基直接还原成醇。
CH3C00H ![]() CH3CH2OH
CH3CH2OH 
上图中乙酸分子键角1>键角2,其原因为_____________。
(3)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,如图1所示。

①图II是磷化硼沿Z轴的投影图,请在图II中圆球上涂“![]() ”和画“×”分别表明B与P的相对位置_____________。
”和画“×”分别表明B与P的相对位置_____________。
②已知晶胞边长为apm,则磷化硼的密度是______g/cm3(只要求列算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.用酸性高锰酸钾溶液可以鉴别己烯、甲苯和苯
B.用系统命名法命名顺﹣2﹣丁烯、反﹣2﹣丁烯分别与HCl加成产物的结果不同
C.聚乳酸(  )分子中存在酯基、羧基、羟基
)分子中存在酯基、羧基、羟基
D.有机物CH3CO18OH和C2H5OH在浓硫酸催化作用下产物为CH3CO18OC2H5和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向10 mL H2O2溶液中加入适量FeCl3溶液,反应分两步进行:
①2Fe3++ H2O2=2Fe2++ O2↑+ 2H+,② H2O2 + 2Fe2+ + 2H+ =2Fe3++2H2O,
反应过程中能量变化如下图所示。下列说法正确的是( )
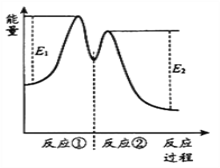
A. 反应②的ΔH=(E2 -E1)kJ·mol-1
B. Fe3+的作用是增大过氧化氢的分解速率
C. 反应2H2O2(aq)=2H2O(l)+O2(g)的△H<0
D. 反应①是放热反应、反应②是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com