
【题目】如图装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中正确的是:

A. 当电路中有0.06 mol电子转移时,乙烧杯中溶液c(H+) 约为0.1 mol · L-1
B. 乙池中的还原产物为SO42-
C. 电池工作时,甲烧杯中溶液的pH逐渐增大
D. 电池工作时,盐桥中的K+移向乙烧杯,外电路的电流方向是从b到a
【答案】C
【解析】
该装置为原电池,由于KMnO4具有强氧化性,NaHSO3具有较强的还原性,因此甲烧杯中石墨作正极:MnO4-+5e-+ 8H+=Mn2++4H2O,乙烧杯中石墨作负极:HSO3--2e-+H2O=SO42-+3H+,由此分析。
A.该装置为原电池,由于KMnO4具有强氧化性,NaHSO3具有较强的还原性,因此乙烧杯中石墨作负极:HSO3--2e-+H2O=SO42-+3H+,当电路中有0.06 mol电子转移时,乙烧杯中生成H+的物质的量=![]() ×0.06mol=0.09mol,乙烧杯溶液c(H+) =
×0.06mol=0.09mol,乙烧杯溶液c(H+) =![]() =0.3 mol · L-1,A项错误;
=0.3 mol · L-1,A项错误;
B.乙池中石墨作负极,HSO3-被氧化,其氧化产物为SO42-,B项错误;
C. 电池工作时,甲烧杯中石墨作正极,发生的电极反应为MnO4-+5e-+ 8H+=Mn2++4H2O,H+不断消耗,溶液的酸性减小,所以pH逐渐增大,C项正确;
D. 电池工作时,盐桥中的K+移向正极,即向甲烧杯迁移,外电路的电流方向是从a到b,D项错误;答案选C。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:

(1)若开始时开关K与a连接,则A极的电极反应式为____________________B极的Fe发生__________ 腐蚀(填“析氢”或“吸氧”)
(2)若开始时开关K与b连接,下列说法正确的是________(填序号)
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子且此时装置内总反应的离子方程式为_________
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为______________,此时通过阴离子交换膜的离子数________(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口________(填“A”“B”“C”或“D”)导出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备乙酸丁酯的装置如图所示,下列分析错误的是

A. 加入过量乙酸可以提高丁醇的转化率
B. 提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
C. 导气管a起到冷凝回流的作用
D. 制乙酸丁酯的反应温度超过100℃不能用水浴加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)和铜(Cu)在生产生活中有广泛的应用。硒可以用作光敏材料、电解锰行业的催化剂,也是动物体必需的营养元素和对植物有益的营养元素等。氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下所示:

请回答下列问题:
(1)若步骤①中得到的氧化产物只有一种,则它的化学式是____________。
(2)写出步骤③中主要反应的离子方程式:____________________________________。
(3)步骤⑤包括用pH=2的溶液酸洗、水洗两步操作,酸洗采用的酸是__________(写酸的名称)。
(4)上述工艺中,步骤⑥和⑦的作用是_____________。
(5)Se为ⅥA族元素,用乙二胺四乙酸铜阴离子水溶液和硒代硫酸钠(Na2SeSO3)溶液反应可获得纳米硒化铜,硒代硫酸钠还可用于Se的精制,写出硒代硫酸钠(Na2SeSO3)与H2SO4溶液反应得到精硒的化学方程式:_____。
(6)氯化亚铜产率与温度、溶液pH关系如下图所示。据图分析,流程化生产氯化亚铜的过程中,温度过低影响CuCl产率的原因是____________________________________;温度过高、pH过大也会影响CuCl产率的原因是_______________________________。

(7)用NaHS作污水处理的沉淀剂,可以处理工业废水中的Cu2+。已知:25℃时,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15,CuS的溶度积为Ksp(CuS)=6.3×10-36。反应Cu2+(aq)+HS-(aq) ![]() CuS(s)+H+(aq)的平衡常数K=__________(结果保留1位小数)。
CuS(s)+H+(aq)的平衡常数K=__________(结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL 0.1 mol·L-1的一元酸HA溶液中加入0.1 mol · L-1 NaOH溶液,HA和A- 的物质的量分数(α)随溶液pH变化的关系如图所示,下列说法正确的是:

A. pH<5.5时,c(HA)<c(A-)
B. pH>8时,c(Na+)+c(H+)>c(A-)
C. pH=7时,c(HA)>c(A-)>c(OH-)=c(H+)
D. pH=5时α(HA)与α(Aˉ)之和比pH=9时α(HA)与α(Aˉ)之和大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表第四周期Ⅷ族,其基态原子中未成对电子个数为___________。
(2)基态Fe3+的核外电子排布式___________
(3)铁氧体是一种磁性材料,工业上制备时常采用水解法,制备时常加入尿素(CO(NH2)2)、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是___________,分子中σ键与π键的数目之比为___________。醋酸钠中碳原子的杂化类型___________。
(4)铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱,已知氨(NH3熔点:-77.8%℃、沸点:-33.5%℃),联氨(N2H4熔点:2℃、沸点:113.5°C)解释其熔沸点高低的主要原因______________________。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数为6,为确定钻的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,则第一种配合物的配体为___________。在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________。

(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如上图所示,则该物质的化学式为___________。若品体密度为dg·cm-3,则晶胞中最近的两个碳原子的距离为___________pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有解热镇痛及抗生素作用的药物“芬必得”主要成分的结构简式如图,它属于( )

①芳香族化合物 ②脂肪族化合物 ③有机羧酸 ④有机高分子化合物 ⑤芳香烃
A. ③⑤ B. ②③ C. ①③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作及其描述错误的是( )
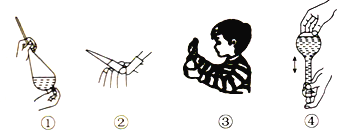
A. ①为萃取时的振荡操作,振荡过程中应打开活塞放气
B. ②为酸式滴定管排气操作,排气后记录初始读数
C. ③为闻气体气味的操作,无论有毒无毒都不能将鼻孔凑近瓶口
D. ④为配制溶液过程中摇匀的操作,摇匀后如果发现液面低于刻度线也不能再加水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com