
【题目】下列操作及其描述错误的是( )
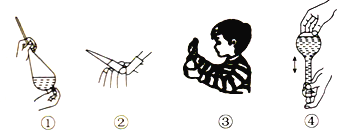
A. ①为萃取时的振荡操作,振荡过程中应打开活塞放气
B. ②为酸式滴定管排气操作,排气后记录初始读数
C. ③为闻气体气味的操作,无论有毒无毒都不能将鼻孔凑近瓶口
D. ④为配制溶液过程中摇匀的操作,摇匀后如果发现液面低于刻度线也不能再加水
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】如图装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中正确的是:

A. 当电路中有0.06 mol电子转移时,乙烧杯中溶液c(H+) 约为0.1 mol · L-1
B. 乙池中的还原产物为SO42-
C. 电池工作时,甲烧杯中溶液的pH逐渐增大
D. 电池工作时,盐桥中的K+移向乙烧杯,外电路的电流方向是从b到a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途。请回答下列问题。
(1)基态硫离子价层电子的轨道表达式为___________,其电子填充的最高能级的轨道数为___________。
(2)常见含硫的物质有单质硫(S8)、SO2、Na2S、K2S等,四种物质的熔点由高到低的顺序依次为___________,原因是___________。
(3)方铅矿(即硫化铅)是一种比较常见的矿物,酸溶反应为:PbS+4HCl(浓)=H2[PbCl4]+H2S↑,则H2[PbCl4]中配位原子是_________,第一电离能I1(Cl)___________I1(S)(填“>”、“<”或¨=”),H2S中硫的杂化方式为_______,下列分子空间的构型与H2S相同的有___________。
A.H2O B.SO3 C.O3 D.CH4
(4)方铅矿的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的___________空隙中。已知晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶胞中硫离子与铅离子最近的距离为___________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用氢气合成氨气的原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
(1)用太阳能分解水制备H2是一项新技术,其过程如下

已知:2H2O(g)=2H2(g)+O2(g) ΔH=+483.6kJ·mol-1 2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.8kJ·mol-1
①过程Ⅱ的热化学方程式是____________________________________.
②整个过程中,Fe3O4 的作用是________________________.
(2)在2L密闭容器中通入3molH2和1molN2,测得不同温度下,NH3的产率随时间变化如图所示.

①下列有关说法正确的是_______________________
A 由b点到c点混合气体密度逐渐增大
B 达到平衡时,2v正(H2)=3v逆(NH3)
C 平衡时,通入氩气平衡正向移动
D 平衡常数,ka<kb=kc
②T1 温度时,0-15min内v(H2)=___________ mol·L-1·min-1.
③已知:瞬时速率表达式v正=k正c3(H2)c(N2),v逆=k逆c2(NH3)(k 为速率常数,只与温度有关).温度由T1 调到T2,活化分子百分率 ______________(填“增大”“减小”或“不变”),k正增大倍数______________k逆增大倍数(填“大于”“小于”或“等于”).T1℃时,k正/k逆=__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. CH3CH2CH(CH3)CH3的名称为3一甲基丁烷
B. CH3CH2CH2CH2CH3和CH3CH2CH(CH3)CH3互为同素异形体
C. ![]() 和
和![]() 为同一物质
为同一物质
D. CH3CH2OH和CH2OHCHOHCH2OH具有相同的官能团,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K 时,把0.5 mol N2O4气体通入体积为5 L的真空密闭容器中,立即出现红棕色,化学方程式为N2O4 ![]() 2NO2。下列条件的改变对其反应速率几乎无影响的是 ( )
2NO2。下列条件的改变对其反应速率几乎无影响的是 ( )
A. 增加NO2的物质的量 B. 将容器的体积缩小一半
C. 保持体积不变,充入N2使体系压强增大 D. 保持压强不变,充入N2使容器体积变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.氮氧化物的存在会破坏地球环境,人们一直在积极探索改善大气质量的有效措施。已知:N2(g)+O2(g)![]() 2NO(g) △H=+181.5kJ·mol-1
2NO(g) △H=+181.5kJ·mol-1
(1)氮氧化物是形成臭氧层空洞光化学烟雾、_______(列举一种)等大气污染现象的物质之一。
(2)某科研小组尝试利用固体表面催化工艺进行NO的分解。若用![]() 、
、![]() 、
、![]() 和
和![]() 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是_______(填字母序号)。
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是_______(填字母序号)。

(3)温度为T1时,在容积为1L的恒容密闭容器中充入0.6molNO2,仅发生反应2NO2(g)![]() 2NO(g)+O2(g) △H>0,达平衡时c(O2)=0.2mol·L-1,则该温度下反应的平衡常数为______。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆= v (NO2)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,仅受温度影响。当温度改变为T2时,若k正=k逆,则T1_____T2(填“>”或“<”)。
2NO(g)+O2(g) △H>0,达平衡时c(O2)=0.2mol·L-1,则该温度下反应的平衡常数为______。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆= v (NO2)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,仅受温度影响。当温度改变为T2时,若k正=k逆,则T1_____T2(填“>”或“<”)。
Ⅱ.氮氧化物(NOx)是电厂主要排放的污染物之一。工业上采用氨脱硝处理后排放,原理如下:
①4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H1=-1632.4kJ·mol-1;
4N2(g)+6H2O(g) △H1=-1632.4kJ·mol-1;
②4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H2=akJ·mol-1;
5N2(g)+6H2O(g) △H2=akJ·mol-1;
当反应温度过高时,NH3发生氧化反应:
③4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H3=-902.0kJ·mol-1。
4NO(g)+6H2O(g) △H3=-902.0kJ·mol-1。
(4)反应②中的a=______。
(5)反应②中,常用的催化剂有Cr2O3和Fe2O3,Cr2O3的催化效率更好一些。下列表示两种催化剂在反应②催化过程中的能量变化示意图合理的是______(填选项字母)。

Ⅲ.利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度的10倍),装置示意图如下,固体电解质可传导O2-
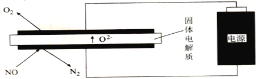
(6)阴极的电极反应式为______。
(7)消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)______。
(8)通过更换电极表面的催化剂可明显改善这一状况,利用催化剂具有______性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示的实验装置进行铁与水蒸气的实验,并研究铁及其化合物的部分性质。
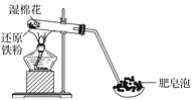
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为______________________。
(2)该同学为确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色,则说明硬质试管的固体物质中一定有___,可能有___;若溶液未变红色,则说明硬质试管中固体物质的成分是___________。
(3)该同学按(2)中所述实验方案进行了实验,结果溶液未变红色,原因是________(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其与NaOH溶液反应。若按图所示操作,可观察到试管中先生成白色沉淀,后沉淀迅速变成灰绿色,最后变成红褐色的现象,请写出白色沉淀变为红褐色的过程中所发生反应的化学方程式:_________________。

(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+具有_____性。由此可知,实验室中含有Fe2+的盐溶液需现用现配制的原因是______,并且配制含Fe2+的盐溶液时应加入少量_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫原子的质量是a g,12C原子的质量是b g,若NA表示阿伏加德罗常数,则下列说法中正确的是
①该硫原子的相对原子质量为12a/b ②m g该硫原子的物质的量为m/aNA mol
③12C原子的摩尔质量是12g或bNA g ④a g该硫原子所含的电子数为16
A.①③④B.②③④C.①②④D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com