
【题目】影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.他们只利用Al、 Fe、Mg和不同浓度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L).设计实验方案来研究影响反应速率的因素。
实验一:甲同学研究的实验报告如下表:

(1)该同学的实验目的是__________________
要得出正确的实验结论,还需控制的实验条件是_____________。
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验

(2)乙同学在实验中应该测定的数据是_____________________。
(3)乙同学完成该实验应选用的实验药品是________________;
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是_____________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入________。
A.硫酸钾 B.硫酸锰 C.氯化钾 D.水
【答案】
实验一:
(1)比较反应物本身的性质对反应速率的影响;温度相同
(2)测定和比较同时间内产生氢气的体积(或测定比较产生同体积氢气所需时间的长短)
(3)Mg(或Fe)和0.5 mol/L硫酸和2 mol/L硫酸
实验二:
(1)Mn2+的催化作用(或催化剂)(2)B
【解析】
试题分析:实验一:(1)根据步骤和现象,目的是探究金属(反应物)本身的性质与反应速率的关系;要比较金属和稀硫酸的反应快慢,则应该使变量只有一个,即要温度相同。(2)要定量研究,需要测定一定时间内产生气体的体积(或产生一定体积的气体所需要的时间)。(3)浓硫酸和金属反应不能生成氢气,所以选择的药品是Mg(或Fe)、0.5 mol/硫酸和2mol/L硫酸。
实验二:(1)KMnO4与H2C2O4反应生成硫酸锰,锰离子有催化作用。(2)为了做对照实验,故应在实验开始前加入硫酸锰。


科目:高中化学 来源: 题型:
【题目】汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)![]() 2NO(g)ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g)ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为_________________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡状态的标志__________。
A.消耗1 mol N2同时生成1 mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,右图变化趋势正确的是________(填字母序号)。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数________。(填“变大”、“变小”或“不变”)
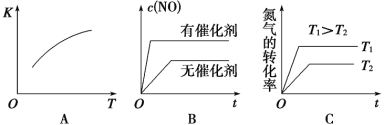
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2 mol/L和3.0×10-3 mol/L,此时反应_____________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )
A.电解时以精铜作阳极
B.电解时阴极发生氧化反应
C.粗铜连接电源负极,其电极反应是Cu-2e-=Cu2+
D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用。其制备路线如下:

已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+; SnCl2能水解生成碱式氯化亚锡[Sn(OH)Cl]。
(1)写出物质A的名称: 。
(2)SnCl2用盐酸而不用水溶解的原因是: 。
(3)锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式: 。
(4)反应I生成的沉淀为SnO,写出该反应的化学方程式: 。
(5)实验室中“漂洗”沉淀的实验操作方法是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1451.6kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ/mol
(1)写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式_______________
(2)某小组根据甲醇燃烧的反应原理,设计如图所示的电池装置:
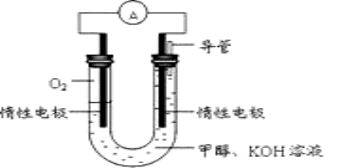
该电池正极的电极反应式____________________
工作一段时间后,测得溶液的pH______________(填增大、减小或不变),则该电池总反应的离子方程式__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于合成高分子化合物的说法正确的是
A. 涤纶、锦纶、蚕丝都属于合成纤维
B. 塑料、合成树脂和合成橡胶被称为“三大合成材料”
C. 酚醛树脂是酚类物质和醛类物质加聚而成的高分子化合物
D. “尿不湿”中的高吸水性树脂属于功能高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解后,向混合溶液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断正确的是( )

A.AB段发生反应的离子方程式为Ba2++SO42-=BaSO4↓
B.BC段发生反应的离子方程式为H++OH-=H2O
C.D点表示的沉淀的化学式为Al(OH)3
D.E点时溶液中含有大量的AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[实验化学]对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到。
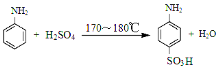
已知:100 mL水在20℃时可溶解对氨基苯磺酸1.08 g,在100℃时可溶解6.67 g。
实验室可用苯胺、浓硫酸为原料,利用右图所示实验装置合成对氨基苯磺酸。实验步骤如下:步骤1:在一个250 mL三颈烧瓶中加入10 mL苯胺及几粒沸石,将三颈烧瓶放在冰水中冷却,小心地加入18 mL浓硫酸。在三颈烧瓶的两个瓶口上分别装冷凝管、温度计,另一个没有使用的瓶口用塞子塞紧。将三颈烧瓶置于油浴中缓慢加热至170~180℃,维持此温度2~2.5小时。
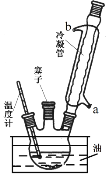
步骤2:将反应产物冷却至约50℃后,倒入盛有100 mL冷水的烧杯中,用玻璃棒不断搅拌,促使对氨基苯磺酸晶体析出。用该烧杯中的少量冷水将烧瓶内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到对氨基苯磺酸粗产品。
步骤3:将粗产品用沸水溶解,冷却结晶,抽滤,收集产品,晾干可得纯净的对氨基苯磺酸。
(1)实验装置中冷凝管由 处(填“a”或“b”)通入冷凝水。
(2)步骤1油浴加热的优点有 。
(3)步骤2中用玻璃棒不断搅拌可促使对氨基苯磺酸晶体析出的理由是 ,用少量冷水洗涤的目的是 。
(4)步骤2和3均进行抽滤操作,在抽滤完毕停止抽滤时,应注意先拆下连接泵和吸滤瓶的橡皮管,然后关闭水龙头,其目的是 。
(5)步骤3中若溶液颜色过深,可用 进行脱色处理。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用键能大小解释的事实是
A. 稀有气体化学性质很稳定 B. 硝酸易挥发,而硫酸难挥发
C. 氮气的化学性质比氧气稳定 D. 常温常压下,溴呈液态,碘呈固态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com