
【题目】海洋植物如海带、海藻中含有丰富的碘元素。碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下:
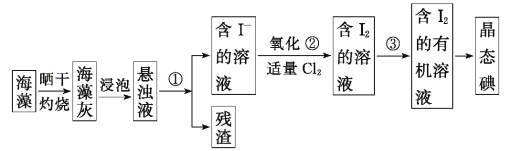
下列说法不正确的是
A.灼烧时用到的仪器有:酒精灯、玻璃棒、石棉网、烧杯
B.①、③两步实验操作分别为过滤和萃取
C.②反应的离子方程式为:Cl2 + 2I- = 2Cl- + I2
D.②中氧化剂也可用溴水代替
【答案】A
【解析】
由实验流程可知,海藻晒干在坩埚中灼烧得到海藻灰,浸泡后得到海藻灰悬浊液,分离难溶性固体和溶液采用过滤方法,可知①为过滤,过滤后得到残渣和含有碘离子的溶液,②中加入适量氯水得到含有碘水溶液,向含有碘水的溶液中加入萃取剂,得到含有碘的有机溶液,通过蒸馏得到碘晶体,以此来解答。
A. 灼烧时用到的仪器有:坩埚、三角架、泥三角、酒精灯、坩埚钳等仪器,故A错误;
B. ①分离难溶性固体和溶液采用过滤方法,③是将碘单质从水溶液中转移到有机溶剂中应采用萃取法,故B正确;
C. ②中通足量的氯气将碘离子氧化成碘单质,反应为Cl2 + 2I- = 2Cl- + I2,故C正确;
D.溴单质的氧化性也大于碘单质,因此溴单质也能将碘离子氧化成碘单质,可用溴水代替氯水,故D正确;
答案选A。


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
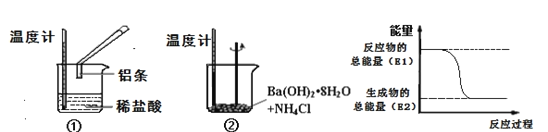
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化。
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是__热反应,Ba(OH)28H2O与NH4Cl反应时,需要将固体研细其目的是__,反应过程__(填“①”或“②”)的能量变化可用图表示。
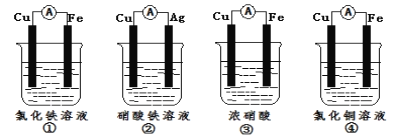
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是__(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
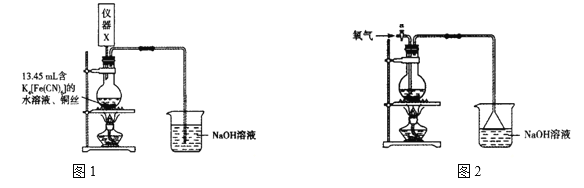
【题目】某兴趣小组为探究铜与浓硫酸反应时硫酸的最低浓度,设计了如下方案。
方案一、实验装置如图1所示。
已知![]() 能与
能与![]() 在酸性溶液中反应生成红棕色沉淀,可用于鉴定溶液中微量的
在酸性溶液中反应生成红棕色沉淀,可用于鉴定溶液中微量的![]() 。
。
(1)写出铜与浓硫酸反应的化学方程式:____________。NaOH溶液的作用是___________。
(2)仪器X的作用是盛装![]() 的浓硫酸并测定浓硫酸的体积,其名称是_______。
的浓硫酸并测定浓硫酸的体积,其名称是_______。
(3)实验过程中,当滴入浓硫酸的体积为20.00 mL时,烧瓶内开始有红棕色沉淀生成,则能与铜反应的硫酸的最低浓度为__________![]() (精确到小数点后一位;混合溶液的体积可视为各溶液的体积之和)。
(精确到小数点后一位;混合溶液的体积可视为各溶液的体积之和)。
方案二、实验装置如图2所示。
加热,充分反应后,由导管a通入氧气足够长时间,取下烧杯,向其中加入足量的![]() 溶液,经过滤、洗涤、干燥后称量
溶液,经过滤、洗涤、干燥后称量![]() 固体的质量。
固体的质量。
(4)通入氧气的目的是______________、____________。
(5)若通入氧气的量不足,则测得的硫酸的最低浓度__________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeO( OH)在高档涂料、油墨的生产中有着重要的用途。某化工厂以氧化铁废料(含少量的 FeO、SiO2)为原料制备FeO(OH)的流程如图所示:
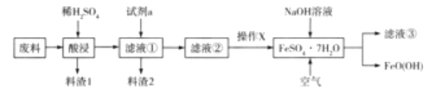
请回答下列有关问题:
(1)FeO( OH)中铁元素的化合价为____,滤液3中溶质的主要成分是______
(2)酸浸时主要反应的离子方程式为______,试剂a最好是_____。
(3)通入空气的反应中,消耗的氧化剂与还原剂的物质的量之比为______。操作X为向滤液2中加入乙醇而不是蒸发浓缩、冷却结晶,这说明绿矾晶体在乙醇中的溶解度_____(填“大”或“小”)。
若操作X为蒸发浓缩、冷却结晶,可能造成的不良后果是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A. 按系统命名法,化合物![]() 的名称为2-乙基丙烷
的名称为2-乙基丙烷
B. 丙烯分子中,最多有7个原子共面
C. 蔗糖和淀粉的水解产物相同且均为葡萄糖
D. 向鸡蛋清中加入Pb(CH3COO)2或(NH4)2SO4溶液均会产生沉淀,两者的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列微粒:① 16O ② 35Cl2 ③ 18O ④ 14N ⑤ 14C ⑥ H ⑦ D ⑧ 37Cl2
(1)互为同位素的是:_______;(填序号,下同)中子数相等的是:_______
(2)同位素原子可以用作“示踪原子”,研究一些反应机理。
①已知可逆反应2SO2+O2![]() 2SO3 ,向一密闭容器内充入SO2和18O2,反应一段时间后,18O可能存在于_______
2SO3 ,向一密闭容器内充入SO2和18O2,反应一段时间后,18O可能存在于_______
A. 仅O2中 B. 仅SO3中 C. 仅O2和SO3中 D. O2 、 SO2 、SO3中
②根据乙酸和乙醇发生反应的原理,写出CH3CO18OH与CH3CH2OH反应的化学方程式:_______。
(3)20g D2O中质子的物质的量为:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V 1 mL 0.1mol·L-1的Fe2(SO4)3溶液与2mL 0.1mol·L-1KI溶液混合,待充分反应后,下列方法可证明该反应具有一定限度的是( )
A.若V1<1,加入淀粉B.若V1≤1,加入KSCN溶液
C.若V1≥1,加入AgNO3溶液D.加入Ba(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z均是中学化学中常见的物质,某同学用X、Y两种单质及Z的溶液进行实验,部分实验内容如下表所示:
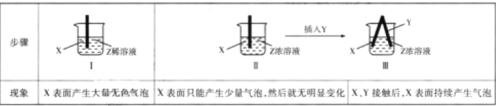
(1)I中反应物与生成物总能量的大小E(反应物)_____E(生成物)(填“ >”“< ”或“=”),仅仅由I、II中的信息可知,Z可能是_____。
(2)若X是铝,在温度不变时向I中分别加入(适量)等物质的量的NaCl、KCl、CsCl后,产生无色气泡的速率明显加快,导致这种变化最可能的原因是_________。
(3)若X是铝,II中反应产生的气泡有特殊颜色,则发生反应的离子方程式为_____;单质Y不可能是____(填字母)。
A 铅 B 石墨 C 镁 D 银
(4)若Ⅲ溶液最终变成蓝色,写出负极上电极反应式_______;变化过程中,参与正极上放电的离子是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年中国防治禽流感药物研究取得重大突破,从中药材提取的金丝桃素对人感染的H5N1亚型禽流感家禽活体具有良好的治愈率。已知金丝桃素的结构简式如下:
![]()
下列有关说法正确的是( )
A.金丝桃素的分子式为C17H22O3N
B.金丝桃素能在NaOH溶液中加热反应得到两种芳香族化合物
C.金丝桃素能与浓硫酸和浓硝酸的混合液反应
D.在金属镍催化并加热下,1mol金丝桃素最多能与4molH2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com