
X、Y、W、M、N五种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族元素氢化物的沸点高,但在同周期中却不是最高的。W是同周期元素中离子半径最小的元素。M原子的最外能层上有两个运动状态不同的电子。N是一种“明星金属”,广泛应用于航天、军事等工业领域。请回答下列问题:
⑴X、Y两种元素的元素符号是: 、 。X、Y可以形成一种共价化合物,其中两种元素最外层电子数都达到8,则其分子的空间构型是: ;中心原子的杂化方式是: 。
⑵X的氢化物易溶于水的其原因是: 。
⑶N的电子排布式是: 。
⑷X和Y两元素的第一电离能大小关系: 小于 (填元素符号)。
(1)N F三角锥 SP3 (2)氨气与水反应,氨气与水可以形成氢键,氨气分子是极性分子(3)1s22s22p63s23p63d24s2.(4)N小于F
【解析】
试题分析:根据题意可推知这五种元素分别是:X是N;Y是F;W是Al; M 是Ca;N是Ti。(1)X、Y两种元素的元素符号是N、F。X、Y可以形成一种共价化合物,其中两种元素最外层电子数都达到8。该分子为NF3。其分子的空间构型与NH3类似,是三角锥形。中心原子N的杂化方式是SP3 。⑵X的氢化物NH3易溶于水是因为NH3是极性分子,水分子是极性分子根据相似相溶原理,以极性分子构成的物质容易溶解于由极性分子组成的物质中。而且氨气与水反应,产生一水合氨。⑶22号元素Ti的电子排布式是1s22s22p63s23p63d24s2。⑷一般情况下,同一周期的元素,元素的非金属性越强,原子的半径越小,失去电子越难。非金属性N<F,所以这两元素的第一电离能大小关系N<F。
考点:考查元素的推断、分子的空间构型、分子中原子的杂化方式、原子核外电子排布、电离能大小的比较及相似相溶原理的应用的知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015届湖北省高三上学期起点考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.碘化铵和氯化铵受热分解过程中破坏和形成的化学键类型完全相同
B.反应N2H4(l)=N2(g)+2H2(g)是一个△S>0的反应
C.1 mol FeCl3完全水解得到的Fe(OH)3胶体中胶粒数目为NA(NA为阿伏加德罗常数)
D.HClO是弱酸,所以NaClO是弱电解质
查看答案和解析>>
科目:高中化学 来源:2015届湖北省新高三起点调研测试化学试卷(解析版) 题型:选择题
下列物质中,既含有极性键又含有非极性键的是:
A.  B . CO2 C . Na2O2 D . NH4Cl
B . CO2 C . Na2O2 D . NH4Cl
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高三上学期起点考试化学试卷(解析版) 题型:选择题
用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L(标准状况)氧气,从而可知M的相对原子质量是( )
A. B.
B.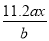 C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高三上学期起点考试化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大,X的原子在元素周期表中原子半径最小,Y 的次外层电子数是最外层的 ,ZX2是一种储氢材料,W与Y属于同一主族,下列叙述正确的是( )。
,ZX2是一种储氢材料,W与Y属于同一主族,下列叙述正确的是( )。
A.原子半径:rW>rZ>rY
B.Y形成的离子与W形成的离子的电子数不可能相同
C.化合物X2Y、ZY、WY3 中化学键的类型相同
D.由X、Y、Z、W组成的化合物的水溶液可能显酸性
查看答案和解析>>
科目:高中化学 来源:2015届湖北省孝感市七校联考高二下学期期中考试化学试卷(解析版) 题型:选择题
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为 ( )
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
C.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
D.氨气分子是极性分子而甲烷是非极性分子。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省孝感市七校联考高二下学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是 ( )
A.H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键。
B.HF、HCl、HBr、HI的熔点沸点依次升高。
C.乙醇分子与水分子之间只存在范德华力。
D.氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化学 来源:2015届浙江省协作体高考摸底测试理科综合化学试卷(解析版) 题型:选择题
在2 L的密闭容器中发生反应xA(g)+yB(g) zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
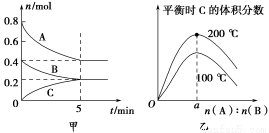
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃时,该反应的平衡常数为25 L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g) zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三上学期期初联考化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子反应方程式为( )
A.NH4HCO3溶于少量的浓KOH溶液中:NH4++ HCO3-+2OH-= CO32-+ NH3↑+2 H2O
B.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-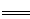 3Fe3++NO↑+3H2O
3Fe3++NO↑+3H2O
C.FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2===2Fe3++4Cl-+Br2
D.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO ===BaSO4↓+H2O
===BaSO4↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com