
【题目】下列指定反应的离子方程式正确的是
A.将Cl2通入热的NaOH溶液:Cl2+6OH-![]() Cl-+ClO3-+3H2O
Cl-+ClO3-+3H2O
B.用醋酸除水垢:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑
C.酸性FeSO4溶液长期放置发生变质:4Fe2++O2+4H+=4Fe3++2H2O
D.向NH4HCO3溶液中加入过量NaOH溶液并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
【答案】C
【解析】
A.将Cl2通入热的NaOH溶液,反应生成氯化钠、氯酸钠和水,反应的离子方程式为:3Cl2+6OH-![]() 5Cl-+ClO3-+3H2O,选项A错误;
5Cl-+ClO3-+3H2O,选项A错误;
B.用醋酸除水垢,反应生成醋酸钙、二氧化碳和水,反应的离子方程式为:2CH3COOH+CaCO3=2CH3COO-+Ca2++H2O+CO2↑,选项B错误;
C.酸性FeSO4溶液长期放置发生变质,反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,选项C正确;
D.向NH4HCO3溶液中加入过量NaOH溶液并加热,反应生成碳酸钠、氨气和水,反应的离子方程式为:HCO3-+NH4++2OH-![]() NH3↑+CO32-+2H2O,选项D错误。
NH3↑+CO32-+2H2O,选项D错误。
答案选C。


科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是( )
实验 | 现象 | 结论 | |
A | 向 | 黄色逐渐消失,加 | 还原性: |
B | 将金属钠在燃烧匙中点燃,迅速伸入集满 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 |
|
C | 向某溶液中先加入氯水,再加入 | 加入 | 最初溶液中含有 |
D | 向2支盛有 | 两只试管中固体均溶解 | 氧化铝是两性氧化物 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2,其简化流程如下:

已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
请回答下列问题:
(1)950℃煅烧磷尾矿生成气体的主要成分是___________。
(2)实验室过滤所需的玻璃仪器是_____________。
(3)NH4NO3溶液能从磷矿Ⅰ中浸取出Ca2+的原因是__________。
(4)在浸取液Ⅱ中通入NH3,发生反应的化学方程式是____________。
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ΔH=-271kJ/mol
5 CaO(s)+3H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) ΔH=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_________________。
(6)在一定条件下CO(g)+H2O(g)![]() CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了
CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了![]() 。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对氯水成分和性质进行探究,实验如下:
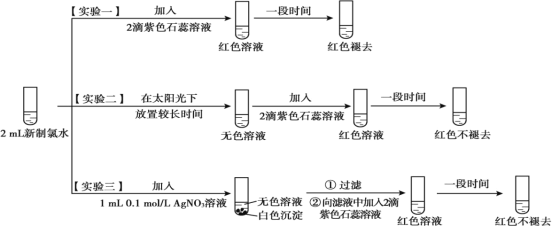
(1)氯水呈黄绿色,说明其中含有_______________(填化学式)。
(2)实验一的现象表明,氯水具有酸性和___________ 性。
(3)氯气与水反应的化学方程式为_______________ 。
(4)用化学用语(化学方程式)说明实验二中“红色不褪去”的原因 ______________________。
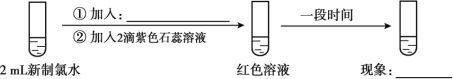
(5)实验四证明了实验三中“红色不褪去”不是因为氯水被稀释所致,补充所加试剂和现象。(实验四)___________、___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到实验目的且符合操作要求的是
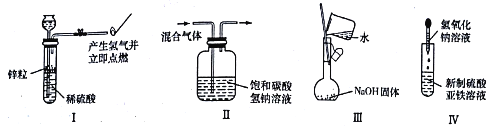
A. I可用于制备并检验氢气的可燃性
B. II可用于除去CO2中的HCl
C. 用Ⅲ来配制一定物质的量浓度的NaOH溶液
D. 用IV中操作制备氢氧化亚铁并观察其颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种电解质溶液可以循环流动的新型电池。下列说法正确的是
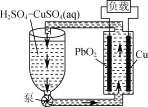
A.Cu电极为正极
B.PbO2电极反应式为PbO2+2e-+4H+=Pb2++2H2O
C.放电后循环液中H2SO4与CuSO4物质的量之比变小
D.若将Cu换成Pb,则电路中电子转移方向改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组请你参与“铁及其化合物”有关性质的实验探究,并共同解答下列问题:
探究一 设计如图所示装置进行“铁与水反应”的实验(夹持仪器略)。

(1)硬质玻璃管B中发生反应的化学方程式为_______________________________。
(2)反应前A中投放碎瓷片的目的是____________________。
(3)装置E中的现象是__________________________________。
探究二 FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.10mol·L-1FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、玻璃棒、胶头滴管外还需的玻璃仪器是________。
(2)下列有关配制过程中说法正确的是________(填序号)。
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(3)请你完成下表,验证假设
实验步骤、预期现象 | 结论 |
①向溶液中加入__________,振荡、静置, 现象:下层呈橙红色,上层呈无色 | 假设1正确 |
②向溶液中加入_____________ 现象:溶液变为红色 | 假设2正确 |
若假设1正确,从实验①中分离出Br2的实验操作名称是_______________ 。
(4)已知:Br2+2Fe2+=2Fe3++2Br-。若在50mL上述FeBr2溶液中通入标准状况112mlCl2,反应的离子方程式为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
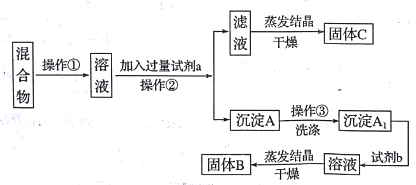
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸。
(1)操作①的名称是_________。
(2)试剂a是_________,试剂b 是_________ 。
(3)加入试剂a所发生反应的离子方程式为_________。加入试剂b所发生反应的离子方程式为_________。
(4)该方案能否达到实验目的:_____(填“能”或“不能”)。若不能,应如何改进? _____(若能,此问不用回答)。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外。至少还要获得的数据是_________的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:

已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为____________。
(4)由E生成F的反应类型为____________。
(5)G是分子式为____________。
(6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,L共有______种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为___________、____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com