
【题目】某实验小组对氯水成分和性质进行探究,实验如下:
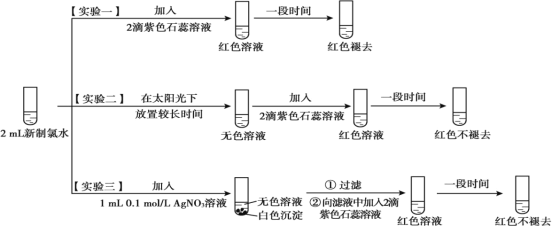
(1)氯水呈黄绿色,说明其中含有_______________(填化学式)。
(2)实验一的现象表明,氯水具有酸性和___________ 性。
(3)氯气与水反应的化学方程式为_______________ 。
(4)用化学用语(化学方程式)说明实验二中“红色不褪去”的原因 ______________________。
(5)实验四证明了实验三中“红色不褪去”不是因为氯水被稀释所致,补充所加试剂和现象。(实验四)___________、___________
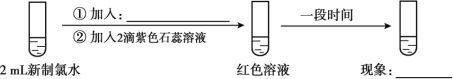
【答案】Cl2 漂白性 Cl2+H2O = HCl + HClO 2HClO= 2HCl+O2↑ 1mL H2O 红色不褪去
【解析】
(1)氯气呈黄绿色,氯水中其它成分都呈无色;
(2)实验一:酸能使紫色石蕊试液变红色,氯水能使红色的溶液褪色;
(3)实验一中紫色石蕊试液变红色,说明有酸生成;最后溶液褪色,说明含有HClO,根据转移电子守恒及元素守恒知,该反应中还有HCl生成;
(4)红色不褪去,说明溶液光照后不存在HClO,则HClO不稳定,光照易分解生成HCl和氧气;
(5)实验四证明了实验三中“红色不褪去”不是因为氯水被稀释所致,应该加入溶剂使溶液变稀检验红色是否褪去。
(1)氯气呈黄绿色,氯水中其它成分都呈无色,所以氯水呈黄绿色,说明其中含有Cl2;
(2)实验一:酸能使紫色石蕊试液变红色,氯水能使红色的溶液褪色,氯水中加入紫色石蕊试液后变红色说明溶液呈酸性,后来溶液褪色,说明具有漂白性;
(3)实验一中紫色石蕊试液变红色,说明有酸生成;最后溶液褪色,说明含有HClO,根据转移电子守恒及元素守恒知,该反应中还有HCl生成,反应方程式为Cl2 +H2O═HCl+HClO;
(4)红色不褪去,说明溶液光照后不存在HClO,则HClO不稳定,光照易分解生成HCl和氧气,反应方程式为2HClO═2HCl+O2↑;
(5)实验四证明了实验三中“红色不褪去”不是因为氯水被稀释所致,应该加入溶剂使溶液变稀检验红色是否褪去,所以需要补充的实验是加入1mL水稀释溶液,且溶液红色不褪去。


科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究硫元素及其化合物的性质具有重要意义。
(1)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与[S2-]关系如下图(忽略溶液体积的变化、H2S的挥发)。
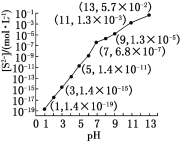
①pH=13时,溶液中的[H2S]+[HS-]=__________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=____________时,Mn2+开始沉淀[已知:Ksp(MnS)=2.8×10-13]。
(2)25 ℃,两种酸的电离平衡常数如下表。
物质 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO的电离平衡常数表达式K=________。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为____________________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]
高锰酸钾(![]() )是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
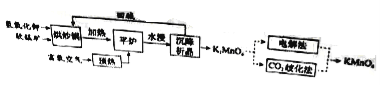
回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 。
(2)“平炉”中发生的化学方程式为 。
(3)“平炉”中需要加压,其目的是 。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“![]() 歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为
,阴极逸出的气体是 。
③“电解法”和“![]() 歧化法”中,K2MnO4的理论利用率之比为 。
歧化法”中,K2MnO4的理论利用率之比为 。
(5)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL,该样品的纯度为
(列出计算式即可,已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于钠及其化合物性质的叙述,正确的是( )
A.钠的化学性质活泼,可以和![]() 溶液反应制取金属钛
溶液反应制取金属钛
B.氧化钠和过氧化钠都能与二氧化碳反应,生成物完全相同
C.过氧化钠是淡黄色固体,可用于呼吸面具中作为氧气的来源
D.![]() 与酸反应的剧烈程度强于
与酸反应的剧烈程度强于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室现需配制物质的量浓度为 1 mol/L 的 NaOH 溶液 480 mL。
(1)配制该溶液的实验步骤包括:
a.计算需要氢氧化钠固体的质量;
b.称量氢氧化钠固体;
c.将烧杯中的溶液注入容量瓶中,洗涤烧杯和玻璃棒,将洗涤液全部转移入容量瓶中;
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却;
e.盖好瓶塞,反复上下颠倒,摇匀;
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用________滴加蒸馏水至凹液面与刻度线相切。上述步骤的正确操作顺序是________。
(2)使用________mL的容量瓶配制此溶液,需要称量NaOH固体的质量为________g。
(3)下列操作会使所配制溶液浓度偏小的有________。
A 容量瓶中原有少量蒸馏水
B 转移溶液时,没有洗涤玻璃棒和溶解用的烧杯
C 定容摇匀后,静置时发现液面低于刻度线,又加水至刻度线
D 定容时,俯视观察液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.将Cl2通入热的NaOH溶液:Cl2+6OH-![]() Cl-+ClO3-+3H2O
Cl-+ClO3-+3H2O
B.用醋酸除水垢:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑
C.酸性FeSO4溶液长期放置发生变质:4Fe2++O2+4H+=4Fe3++2H2O
D.向NH4HCO3溶液中加入过量NaOH溶液并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验溶液中是否含有某种离子,下列操作方法正确的是 ( )
A. 某溶液加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,则一定含有CO32一
B. 某溶液加入氢氧化钠溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则一定含有NH4+
C. 某溶液滴入BaCl2溶液,再滴加稀盐酸,产生白色沉淀,则一定含有SO42一
D. 某溶液加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则一定含有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取少量黑色固体,洗涤后,_______(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据_______现象,判断溶液中存在Ag+,可产生Fe3+。
③ 下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________________。
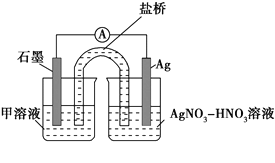
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com