
【题目】反应A(g)B(g)+C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L.温度T1和T2下A的浓度与时间关系如右图所示.回答下列问题:
(1)上述反应的温度T1T2 , 平衡常数K(T1) K(T2).(填“大于”、“小于”或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为 .
②反应的平衡常数K= .
③反应在0~5min区间的平均反应速率v(A)= .
【答案】
(1)小于;小于
(2)0.085mol;0.082;0.007mol/(L?min)
【解析】解:(1)由图可知T2先达平衡状态,所以T1小于T2 , 而温度越高K越小,所以正反应为吸热反应,所以温度越高K值越大,所以答案是:小于;小于;
(2) A(g)B(g)+C(g)
起始浓度:0.050 0 0
变化浓度:0.035 0.035 0.035
平衡浓度:0.015 0.035 0.035
①平衡时体系总的物质的量为=(0.015+0.035+0.035)×1=0.085mol;②K= ![]() =0.082;③反应在0~5min区间的平均反应速率v(A)=
=0.082;③反应在0~5min区间的平均反应速率v(A)= ![]() =0.007mol/(Lmin);所以答案是:0.085mol;0.082;0.007mol/(Lmin).
=0.007mol/(Lmin);所以答案是:0.085mol;0.082;0.007mol/(Lmin).
【考点精析】认真审题,首先需要了解化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%).


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】aLAl2(SO4)3溶液中含有Al3+为b mol,则该溶液里SO42-的物质的量浓度为
A. 3b/2aB. 2b/3aC. 2b/aD. 3b/a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于四氯化碳用于萃取碘水中碘的理由不正确的是 ( )
A. 四氯化碳的密度比水大 B. 四氯化碳与水和碘均不反应
C. 四氯化碳与原溶剂水互不相溶 D. 碘在四氯化碳中的溶解度比在水中大得多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016宜春校级模拟】在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)2HI(g).已知H2和I2的起始浓度均为0.10molL﹣1时,达平衡时HI的浓度为0.16molL﹣1.若H2和I2的起始浓度均变为0.20molL﹣1,则平衡时H2的浓度(molL﹣1)是( )
A.0.16 B.0.08 C.0.04 D.0.02
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016沧州模拟】在一定条件下,反应X(g)+3Y(g)2Z(g)△H=﹣92.4kJmol﹣1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
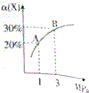
A.图中A、B两点,达到相同的平衡体系
B.上述反应在达到平衡后增大压强,X的转化率提高
C.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
D.将1.0molX,3.0molY,置于1L密闭容器中发生反应,放出的热量为92.4kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017北京一模】K2FeO4在水中不稳定,发生反应:4FeO42﹣+10H2O4Fe(OH)3(胶体)+8OH﹣+3O2,其稳定性与温度(T)和溶液pH的关系分别如图所示.下列说法不正确的是:( )

A.由图Ⅰ可知K2FeO4的稳定性随温度的升高而减弱
B.由图Ⅰ可知温度:T1>T2>T3
C.由图Ⅰ可知上述反应△H<0
D.由图Ⅱ可知图中a<c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用所学化学知识解答问题:
(1)微粒 ![]() Na+中的质子数是 , 中子数是 , 核外电子数是 .
Na+中的质子数是 , 中子数是 , 核外电子数是 .
(2)用电子式表示形成过程:H2S;MgF2 .
(3)写出化学反应方程式:用四氧化三铁铝热法炼铁;电解法冶炼铝 .
(4)有下列各组微粒或物质:
A. ![]() C和
C和 ![]() C
C
B.CH3CH2CH2CH3和 CH3CH2CH(CH3)CH3
C.  和
和 
D.CH3CH2CH2CH3和 ![]()
①两种微粒互为同位素是;②两种物质属于同系物的是;③两种物质互为同分异构体的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为1L的干燥烧瓶中,用排空气法收集NH3气体,测得烧瓶中气体对氢气的相对密度为9.5,此气体中NH3的体积分数约为( )
A. 83% B. 75% C. 50% D. 25%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com