
【题目】【2016宜春校级模拟】在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)2HI(g).已知H2和I2的起始浓度均为0.10molL﹣1时,达平衡时HI的浓度为0.16molL﹣1.若H2和I2的起始浓度均变为0.20molL﹣1,则平衡时H2的浓度(molL﹣1)是( )
A.0.16 B.0.08 C.0.04 D.0.02
【答案】C
【解析】 H2(g)+I2(g)![]() 2HI(g)
2HI(g)
起始浓度0.10molL﹣1 0.10molL﹣1 0
反应浓度0.08molL﹣1 0.08molL﹣1.16molL﹣1
平衡浓度0.02molL﹣1 0.02molL﹣1 0.16molL﹣1
化学平衡常数K=![]() =
=![]() =64
=64
当H2和I2的起始浓度均变为0.20molL﹣1时,设则平衡时H2的浓度为x(molL﹣1),
则氢气的反应浓度为( 0.20﹣x)molL﹣1.
H2(g)+I2(g)![]() 2HI(g)
2HI(g)
起始浓度 0.20molL﹣1 0.20molL﹣1 0
反应浓度 ( 0.20﹣x)molL﹣1 ( 0.20﹣x)molL﹣1 2(0.20﹣x)molL﹣1
平衡浓度 x x 2(0.20﹣x)molL﹣1
化学平衡常数K=![]() =64, x=0.04 molL﹣1; 故选C。
=64, x=0.04 molL﹣1; 故选C。


科目:高中化学 来源: 题型:
【题目】(1)在恒温恒压密闭容器中充入1mol N2和3 mol H2在tl时刻达到平衡状态后,继续充入2 mol NH3,在t2时刻达到平衡状态。画出v(正)和v(逆)随时间t的变化关系__________________

(2)恒温恒容时,下列不能说明合成氨反应达到平衡状态的是__________________
a.容器内N2、H2、NH3的浓度之比为1 : 3 : 2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
e.单位时间内断裂6mol N-H键的同时,有3mol H-H形成
(3)将上述制得的的氨气溶于水配成溶液,25℃时,将amol/L的氨水与bmol/L盐酸等体积混合,反应后溶液恰好显中性,用a、b表示NH3·H2O的电离平衡常数Kb__________________(写出详细计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017海淀区模拟】某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )

A.曲线Ⅰ对应的条件改变可能降低温度
B.曲线Ⅱ对应的条件改变可能是充入氦气
C.该温度下,此反应的化学平衡常数的数值为0.5
D.从反应开始至a 点,ν(CO2)=0.6 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能用勒夏特列原理解释的是
A.H2、I2、HI平衡混合气加压后颜色变深
B.工业上由氢气和氮气合成氨是在较高温度下进行的
C.Fe(SCN)3溶液中加入固体KSCN后颜色变深
D.SO2催化氧化成SO3的反应,往往需要使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯水加热到较高温度时,下列叙述正确的是
A.水的离子积变大、pH变小、呈酸性
B.水的离子积不变、pH变大、呈中性
C.水的离子积变小、pH变小、呈碱性
D.水的离子积变大,pH变小、呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)B(g)+C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L.温度T1和T2下A的浓度与时间关系如右图所示.回答下列问题:
(1)上述反应的温度T1T2 , 平衡常数K(T1) K(T2).(填“大于”、“小于”或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为 .
②反应的平衡常数K= .
③反应在0~5min区间的平均反应速率v(A)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列液体中,滴入水中会出现分层现象,但在滴入热的氢氧化钠溶液中时分层现象会逐渐消失的是(不考虑有机物的挥发)( )
A. 溴乙烷 B. 乙醇 C. 苯 D. 苯乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016·西安一模】某化学兴趣学习小组设计实验探究金属M与浓硫酸反应的气体产物。
[提出假设] 假设1:气体产物只有SO2; 假设2:_______________。
[实验设计]为了探究金属M与浓硫酸反应产物,设计如图实验装置:一定量的浓硫酸与金属M反应。
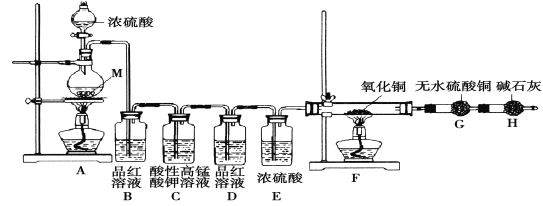
(1) 检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在H装置后面连上一根导管,然后 ,则证明装置的气密性良好。
(2)若B瓶里品红溶液褪色,E、F和G中都无明显现象。反应后硫酸盐中金属显+2价。写A中发生反应的化学方程式: ;
(3)若假设2正确,则可观察到:F管中 ;G干燥管里 。
[实验反思] 为了进一步探究金属M成分和气体组分,进行如下实验:
称取11.2g金属M放入装置A中,加入一定量的浓硫酸,反应结束后,B瓶里品红溶液褪色,金属没有剩余,拆下G并称重,G增重0.9g。
(4)为了观察溶液颜色,实验完毕后,需要稀释烧瓶里溶液。稀释烧瓶里溶液的操作方法: 。
(5)将稀释后的溶液分装甲、乙试管,向甲试管里滴加KSCN溶液,溶液变红色;向乙试管里滴加酸性高锰酸钾溶液,振荡,溶液紫色褪去。如果烧瓶溶液中金属离子浓度相等,则气体成分及物质的量为 。试写出烧瓶里发生反应的总化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com