
| A. | $\stackrel{20}{10}$Ne和$\stackrel{22}{10}$ Ne互为同位素 | B. | $\stackrel{20}{10}$Ne和$\stackrel{22}{10}$Ne互为同素异形体 | ||
| C. | 具有相同的中子数 | D. | $\stackrel{20}{10}$Ne与羟基(-OH)所含电子数相等 |
分析 根据原子符号中,左上角数字代表质量数,左下角数字为质子数,在原子中,核电荷数=质子数=核外电子数,质量数=质子数+中子数;具有相同质子数,不同中子数的不同原子互为同位素,同一元素形成的不同单质互为同素异形体来解答.
解答 解:A、$\stackrel{20}{10}$Ne和$\stackrel{22}{10}$ Ne的质子数相同,都为10,中子数不相同,分别为10、12,属于同位素,故A正确;
B、$\stackrel{20}{10}$Ne和$\stackrel{22}{10}$ Ne是原子,不是单质,不属于同素异形体,故B错误;
C、$\stackrel{20}{10}$Ne和$\stackrel{22}{10}$ Ne的质子数都为10,中子数不相同,分别为10、12,故C错误;
D、$\stackrel{20}{10}$Ne的质子数为10,电子数为10,羟基(-OH)的质子数为9,电子数为10,故D错误;
故选A.
点评 本题主要考查了同位素、同素异形体、元素符号的含义以及粒子数目的关系,难度不大,注意概念的掌握.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5 NA | |
| B. | 足量Cu和含4 mol HNO3的浓硝酸反应可生成2 NA个NO2分子 | |
| C. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| D. | 在pH=13 的NaOH 溶液中,OH-的数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(CO):通过灼热的CuO粉末 | B. | SO2 (HCl):通入饱和碳酸氢钠溶液中 | ||
| C. | NaCl(NH4Cl):加热 | D. | NO2(NO):通入水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
| 一氯乙酸 | K=1.4×10-3 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,H+、Fe3+、Br-、NO3-可以大量共存 | |
| B. | 和足量的Ba(OH)2溶液反应的离子方程式:2NH4++Fe2++2SO42-+2Ba2++4OH-═2NH3•H2O+Fe(OH)2↓+2BaSO4↓ | |
| C. | 和KMnO4溶液反应后溶液可以褪为无色 | |
| D. | 该溶液与氢氧化钠溶液共热,产生的气体能使湿润的蓝色石蕊试纸变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
 ; X、Y、Z三种元素的原子半径从大到小的顺序是Mg>N>O (用元素符号表示).
; X、Y、Z三种元素的原子半径从大到小的顺序是Mg>N>O (用元素符号表示).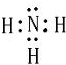 ;化合物ZY中存在的化学键类型为离子键 (填“离子键”或“共价键”).
;化合物ZY中存在的化学键类型为离子键 (填“离子键”或“共价键”).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有卤代烃都是无色、难溶于水,比水重的液体 | |
| B. | 所有卤代烃在适当条件下都能发生取代反应 | |
| C. | 所有卤代烃在适当条件下都能发生消去反应 | |
| D. | 氟氯代烷(即氟利昂)是优良的制冷剂、灭火剂,需推广使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com