
【题目】当氢氧化镁固体在水中达到溶解平衡 Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),为使固体的量减少,可加入少量的( )
Mg2+(aq)+2OH-(aq),为使固体的量减少,可加入少量的( )
A. NH3 ·H2O B. NaOH C. MgSO4 D. NaHSO4
科目:高中化学 来源: 题型:
【题目】【银川市第二中学2017届下学期第三次模拟考试】下列关于有机物的说法正确的是
A.分子式为CH4O和C2H6O的有机物一定互为同系物
B.在酸性条件下,C2H5CO18OC2H5的水解产物是C2H5CO18OH和C2H50H
C.分子式为C6H12且碳碳双键在碳链末端的烯烃共有6种同分异构体(不考虑立体异构)
D.三联苯(![]() )的一氯代物有4种
)的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若阿伏加德罗常数的数值用NA表示,下列说法正确的是(相对原子质量:H-1 D-2 He-4 N-14 O-16)
A. 标准状况下,1.12L 氦气所含原子数为0.1NA
B. 22.4 LHCl溶于水,溶液中H+数为NA
C. 1.6gNH2-离子所含电子数为NA
D. 10g D2O所含的中子数为4.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【衡阳市2017届下学期第三次联考】在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.10 | 0.09 |
② | 800 | 0.20 | 0.20 | 0.10 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法错误的是
A.实验①中,若5min时测得n(M) =0.05mol,则0至5min时间内,用N表示的平均反应速率v(N) =0.01 mol/( L·min)
B.实验②中,该反应的平衡常数K= 1.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.06
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生产生活中用途广泛。利用FeSO4制备还原铁粉的工业流程如下:
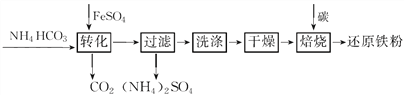
实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3在如下装置模拟上述流程中的“转化”环节。
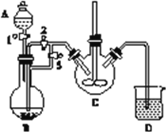
(1)装置A的名称是________,装置B中盛放的试剂是________,NH4HCO3盛放在装置________中。
(2)实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合制FeCO3沉淀,操作方法是________________,发生主要反应的离子方程式为_____________________。FeSO4溶液要现用现配制的原因是____________,检验久置的FeSO4是否变质的方法是______________。
(3)干燥过程主要目的是脱去游离水,过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为____________________________,取干燥后的FeCO3样品12.49 g,与碳混合后焙烧,最终得到还原铁粉6.16 g,计算样品中杂质FeOOH的质量:________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品。

(1)CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)![]() COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如下表:
COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如下表:
t/min | n(CO)/mol | n(Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
①反应0~2min末的平均速率v(COCl2)=_________________mol/(L·min)。
②在2min~4min间,v(Cl2)正______v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=_________________。
③已知X、L可分别代表温度或压强,图1表示L一定时,CO的转化率随X的变化关系。X代表的物理量是_______________;a_______________0 (填“>”,“=”,“<”).
(2)在催化剂作用下NO和CO转化为无毒气体:
2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)△H=﹣748kJ·mol﹣1
2CO2(g)+N2(g)△H=﹣748kJ·mol﹣1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图2所示.温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是_____________________。
②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法。其中CO传感器的工作原理如图3所示,则工作电极的反应式为___________________;方法2:氧化还原滴定法。用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式__________________。
(3)用CO和H2可以制备甲醇,反应为CO(g)+2H2(g)![]() CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是_____________________。
CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是_____________________。
选考题(19、20两题选做一题)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于燃烧热的说法中正确的是
A.1 mol物质燃烧所放出的热量
B.常温下,可燃物燃烧放出的热量
C.在25°C、1.01×105 Pa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量
D.燃烧热随热化学方程式中的化学计量数的改变而改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【厦门第一中学2017届考前模拟考试】碳酸二甲酯[(CH3O)2CO]是一种具有发展前景的“绿色”化工产品,电化学合成碳酸二甲酯的工作原理如图所示(加入两极的物质均是常温常压下的物质)。下列说法正确的是

A.电解一段时间后,阴极和阳极消耗的气体的物质的量之比为l:2
B.石墨l极发生的电极反应为2CH3OH+CO-e-=(CH3O)2CO+H+
C.石墨2极与直流电源正极相连
D.H+由石墨2极通过质子交换膜向石墨l极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【天津市南开区2017届高三基础训练】下列解释实验过程或事实的反应方程式不正确的是
A.熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH![]() Na2SiO3+H2O
Na2SiO3+H2O
B.在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O
C.红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:
3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
D.“84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气:ClO-+Cl-+2H+=Cl2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com