
【题目】【化学选修:有机化学基础】(15分)
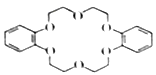
有机物G是一种冠醚,在萃取稀有金属、有机催化等方面有重要用途。有关物质的转化关系如图所示(一些非主要产物已略去):

已知①A的产量可以用来衡量一个国家的石油化工发展水平;②参加反应的E与F的物质的量之比为1:1;③![]()
请回答下列问题:
(1)写出A的结构简式:______________;G的分子式为_____________。
(2)有机物D的核磁共振氢谱中,有________种氢原子。反应⑥的反应类型为___________。
(3)化合物B可由乙烷经三步反应合成:![]()
反应1的试剂与条件为___________;反应2的化学方程式为____________________;反应3的反应类型为_____________。
(4)下列物质能与F发生反应的是_________(填字母)。
A.Na2CO3溶液 B.NaHCO3溶液 C.NaOH溶液 D.酸性KMnO4
(5)E有多种同分异构体,其中能与Cu在加热条件下发生反应,且产物能发生银镜反应的有________种(不考虑立体异构)。
【答案】(1)CH2=CH2(2分);C20H24O6(2分);(2)2(1分);取代反应(1分);
(3)Cl2/光照(2分);CH3CH2Cl+NaOH![]() CH2=CH2↑+NaCl+H2O(2分);加成反应(1分);
CH2=CH2↑+NaCl+H2O(2分);加成反应(1分);
(4)acd(2分);(5)9(2分)。
【解析】
试题分析:根据已知条件可知A是CH2=CH2,由氯乙烯可逆推知C是CH2=CHCl,结合②的反应条件知道B是Cl;D 是HOCH2CH2OH;根据G的结构简式,结合B的组成及反应条件可知E是ClCH2CH2OCH2CH2Cl,则F是 。(1)A是乙烯,结构简式是CH2=CH2,;根据G的结构简式可知其分子式是C20H24O6;(2) D是HOCH2CH2OH,根据分子的对称性可知:分子中含有两种不同化学环境的H原子,所以核磁共振氢谱中,有2种氢原子。反应⑥是2
。(1)A是乙烯,结构简式是CH2=CH2,;根据G的结构简式可知其分子式是C20H24O6;(2) D是HOCH2CH2OH,根据分子的对称性可知:分子中含有两种不同化学环境的H原子,所以核磁共振氢谱中,有2种氢原子。反应⑥是2 +2ClCH2CH2OCH2CH2Cl
+2ClCH2CH2OCH2CH2Cl![]()
 +4,可见发生的反应类型为 取代反应;(3)反应I是乙烷在光照下与氯气反应产生CH3CH2Cl,反应类型是取代反应;反应2是CH3CH2Cl 与NaOH的醇溶液在加热时发生消去反应,化学方程式是CH3CH2Cl +NaOH
+4,可见发生的反应类型为 取代反应;(3)反应I是乙烷在光照下与氯气反应产生CH3CH2Cl,反应类型是取代反应;反应2是CH3CH2Cl 与NaOH的醇溶液在加热时发生消去反应,化学方程式是CH3CH2Cl +NaOH![]() CH2=CH2↑+NaCl+H2O;反应3是乙烯与HClO发生加成反应产生C量CHCHClCH2OH。(4)化合物F是邻二苯酚,含有酚羟基,具有酸性,能与碳酸钠、氢氧化钠发生反应,也一被酸性高锰酸钾溶液氧化,故选项是acd;(5)E的同分异构体发生催化氧化反应的产物能发生银镜反应,说明具有-CH2OH结构,即符合条件的同分异构体的碳架结构有2种:CH3—CH2—CH2—CH2OH、
CH2=CH2↑+NaCl+H2O;反应3是乙烯与HClO发生加成反应产生C量CHCHClCH2OH。(4)化合物F是邻二苯酚,含有酚羟基,具有酸性,能与碳酸钠、氢氧化钠发生反应,也一被酸性高锰酸钾溶液氧化,故选项是acd;(5)E的同分异构体发生催化氧化反应的产物能发生银镜反应,说明具有-CH2OH结构,即符合条件的同分异构体的碳架结构有2种:CH3—CH2—CH2—CH2OH、![]() ;用定-移法确定碳骨架上的二氯代物,前者有6种,后者后3种,故共有9种二氯取代产物。
;用定-移法确定碳骨架上的二氯代物,前者有6种,后者后3种,故共有9种二氯取代产物。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时,最佳顺序为 ( )
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液
A.①③ B.③② C.③① D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是( )
A.MgO、Al2O3熔点高,均可用作耐高温材料
B.NH4HCO3受热易分解,可用作氮肥
C.Fe2(SO4)3易溶于水,可用作净水剂
D.SO2具有氧化性,可用于漂白纸浆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上需要利用一批回收的含铜废料制造胆矾(CuSO4·5H2O)。该废料中各种成份含量如下:Cu和CuO约占87%,其它为Mg、Al、Fe、Si及其氧化物,还有少量的难溶物质。工艺流程为:

部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
请回答下列问题:
(1)步骤①中为什么要将含铜废料研磨成粉状? 。
(2)步骤②中的离子方程式(写出2个即可):
、
。
(3)步骤⑤中H2O2参加反应的离子方程式: 。
(4)步骤⑥中调节溶液pH时适宜的物质是 (填序号)。
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Cu(OH)2 E.MgCO3
(5)步骤⑦中用硫酸调节pH=2~3的原因是 。
(6)步骤⑧的分离方法步骤是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂有废合金(含有铝、铁、铜)粉末,甲同学探索工业废料的利用,用该废合金粉末制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,其实验方案如下:

试回答下列问题:
(1)所加试剂①、②分别是 、 。
(2)操作①的名称为 ,所用的仪器除铁架台、铁圈和烧杯,还需要的器材有 。
(3)由滤液A制AlCl3溶液有途径Ⅰ和途径Ⅱ两种,你认为合理的是__________,理由________________;
写出A→D反应离子方程式:____________________________。
(4)操作③的名称是_________________。
(5)丙同学提出可将方案中最初溶解合金的试剂①改为盐酸,重新设计方案,也能得到三种物质,你认为后者的方案比原方案是否更合理: ,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 含有最高价元素的化合物一定具有强氧化性
B. 失电子越多的还原剂,其还原性就越强
C. 阳离子只能得电子被还原,作氧化剂
D. “A氧化B”与“B被A氧化”,“A被B还原”表达的含义相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用乙醇和浓硫酸反应生成乙烯,乙烯再与溴反应制1,2-二溴乙烷。在制备过程中部分乙醇被浓硫酸氧化产生CO2、SO2,进而与Br2反应生成HBr等酸性气体。
已知:
(1)用下列仪器,以上述三种物质为原料制备1,2-二溴乙烷。如果气体流向为从左到右,正确的连接顺序是(短接口或橡皮管均已略去):B经A①插入A中,D接A②;A③接________接________接________接________。

(2)装置A中碎瓷片的作用是 。若加热一段时间后,发现碎瓷片忘加,应采取的正确操作是( )
A、立即补加
B、冷却后补加
C、不需补加
D、重新配料
(3)装置C的作用是______________________________________。
(4)装置F中盛有10% NaOH溶液的作用是________________________。
(5)在反应管E中进行的主要反应的化学方程式为________________。
(6)处理上述实验后三颈烧瓶中废液的正确方法是________。
A.废液经冷却后倒入下水道中
B.废液经冷却后倒入空废液缸中
C.将水加入烧瓶中稀释后倒入空废液缸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构与性质】(15分)
铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是_________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于_______(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_______;Fe(CO)x在一定条件下发生反应:Fe(CO)x(s)![]() Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
(3)写出CO的一种常见等电子体分子的结构式_______;两者相比较沸点较高的为_____(填化学式)。CN-中碳原子杂化轨道类型为_______,C、N、O三元素的第一电离能最大的为____(用元素符号表示)。
(4)铜晶体中铜原子的堆积方式如图1所示。
①基态铜原子的核外电子排布式为___________。
②每个铜原子周围距离最近的铜原子数目________。

(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(黑点代表铜原子)。
①该晶体的化学式为________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于______(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为___________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源的利用具有广阔前景。海水中主要离子的含量如下表所示。
成分 | 含量(mg·L-1) | 成分 | 含量(mg·L-1) |
Cl- | 18980 | Ca2+ | 400 |
Na+ | 10560 | HCO3- | 142 |
SO42- | 2560 | Br- | 64 |
Mg2+ | 1272 |
利用海水可以提取溴和镁,提取过程如下。

(1)提取溴的过程中,经过两次Br-→Br2转化的目的是:①__ ___,
吸收塔中发生反应的离子方程式是:②_____________ _______。
用平衡移动原理解释通空气的目的:③___ ____________。
(2)吸收塔中也可采用纯碱吸收Br2,主要反应如下,请配平并表示出电子转移的方向和数目:
□Br2+□Na2CO3+□H2O―→□NaBr+□NaBrO3+□NaHCO3
(3)从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是①____ ____、过滤、洗涤、干燥。最后一步冶炼得到金属镁的化学方程式为②____ ____;冶炼时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式③____ __________。
(4)依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2
的体积为________L(忽略Cl2的溶解)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com