
| A. | 0.1mol•L-1的NaHS溶液中离子浓度关系:c(OH-)=c(H+)-c(S2-)+c(H2S) | |
| B. | 浓度为0.1mol•L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | pH=12的氨水与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-) |
分析 A.溶液中电荷守恒和物料守恒计算分析判断;
B.碳酸钠溶液中存在物料守恒,n(Na)=n(C)
C.pH=12的氨水与pH=2的盐酸等体积混合,一水合氨是弱电解质存在电离平衡,反应后一水合氨又电离溶液显碱性;
D.溶液中存在电荷守恒分析判断,溶液呈中性c(H+)=c(OH-);
解答 解:A.溶液中电荷守恒c(OH-)+2c(S2-)+c(HS-)=c(H+)+c(Na+),电荷守恒;c(Na+)=c(S2-)+c(HS-)+c(H2S),计算得到c(OH-)=c(H+)-c(S2-)+c(H2S),故A正确;
B.碳酸钠溶液中存在物料守恒,n(Na)=2n(C),浓度为0.1mol•L-1的碳酸钠溶液中存在物料守恒:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故B错误;
C.pH=12的氨水与pH=2的盐酸等体积混合,一水合氨是弱电解质存在电离平衡,反应后一水合氨又电离溶液显碱性,c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C错误;
D.溶液中存在电荷守恒分析判断,醋酸溶液与NaOH溶液相混合后溶液中存在电荷守恒,c(Na+)+c(H+)=c(OH-)+c(CH3COO-);所得溶液呈中性,溶液呈中性c(H+)=c(OH-),c(Na+)=c(CH3COO-),故D错误;
故选A.
点评 本题考查了电解质溶液中离子浓度大小、电荷守恒、物料守恒和弱电解质电离平衡,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | K+、SO32-、Cl-、NO3- | B. | H+、NH4-、Al3+、SO42- | ||
| C. | Na+、S2-、OH-、SO42- | D. | Na+、Ca2+、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠的水解反应:CO32-+H2O?HCO3-+OH- | |
| B. | 粗铜精炼时,与电源正极相连的是粗铜,电极反应式为:Cu-2e-═Cu2+ | |
| C. | 钢铁发生电化学腐蚀的负极反应式:Fe-2e-═Fe2+ | |
| D. | 碱性氢氧燃料电池负极反应式:O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
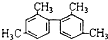 的烃,下列说法正确的是( )
的烃,下列说法正确的是( )| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至少有11个碳原子处于同一平面上 | |
| C. | 该有机物不能使酸性KMnO4溶液褪色 | |
| D. | 该烃属于苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是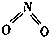 和
和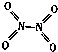 .实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.
.实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:1 | C. | 1:3:2 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 酸性:H2SiO3<H2CO3 | B. | 碱性:Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性:SiH4>PH3 | D. | 原子半径:N<C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com