
【题目】一氯甲烷等卤代烃跟苯的反应如图所示,(无机小分子产物略去)。下列说法正确的是

A. 该反应属于化合反应
B. b的二氯代物有6种结构
C. 1mol b加氢生成饱和烃需要6molH2
D. C5H11Cl的结构有8种
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下图为某漂白剂的结构。已知:W、Y、Z是不同周期、不同主族的短周期元素,W、Y、Z原子最外层电子数之和等于X原子最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述错误的是
![]()
A.W、X对应的简单离子的半径:X>W
B.Y元素在周期表中的位置为二周期第IVA族
C.将W的氯化物的水溶液加热蒸干并灼烧可得到W的氧化物
D.该漂白剂结构中,Y、X原子的最外层均满足8电子结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)元素C、N、O、K的电负性从大到小依次为______。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为______。
(3)下图是周期表中短周期的一部分,A的单质是空气中含量最多的物质,其中第一电离能最小的元素是______(填“A”“B”“C”或“D”)。
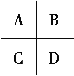
(4)氮化硼(BN)是一种重要的功能陶瓷材料。基态B原子的电子排布式为______;B和N相比,电负性较大的是______,BN中B元素的化合价为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的电子式:
(1)CaCl2:___;Na2S:___;HCl:___。
写出下列物质的结构式:
(2)HClO:___;CO2:___;N2:___。
写出下列物质的结构示意图:
(3)Ca:___;Mg2+:___;F-:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化①碘的升华②烧碱熔化③氯化钠溶于水④氯化氢溶于水⑤氧气溶于水⑥氯化铵受热分解。
氯化铵的电子式是______________;未发生化学键破坏的是______________(填序号,下同);仅发生离子键破坏的是______________;仅发生共价键破坏的是______________;既发生离子键又发生共价键破坏的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W 在工业上常用作溶剂和香料,其合成方法如下:
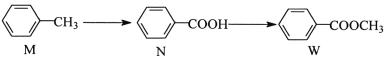
下列说法正确的是( )
A. M、N、W 均能发生加成反应、取代反应
B. N、W 组成上相差一个CH2原子团,所以互为同系物
C. W 属于酯类,酸性水解和碱性水解产物相同
D. 1mol N可与4mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的化合物在科研、生活及化学工业中具有重要的作用。
(1)废水处理领域中,H2S或Na2S能使某些金属离子生成极难溶的硫化物而除去。25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下表(忽略溶液体积的变化、H2S的挥发)。
pH | 3 | 5 | 7 | 9 | 11 |
c(S2-)/ (mol·L-1) | 1.4×10-15 | 1.4×10-11 | 6.8×10-8 | 1.3×10-5 | 1.3×10-3 |
某溶液含0.020 mol·L-1 Mn2+、0.10 mol·L-1 H2S,当溶液pH=5时,Mn2+开始沉淀,MnS的溶度积为_______。
(2)工业上采用高温分解H2S制取氢气,其反应为2H2S(g)![]() 2H2(g)+S2(g),在膜反应器中分离出H2。
2H2(g)+S2(g),在膜反应器中分离出H2。
①在密闭容器中,充入0.10 mol H2S(g),发生反应2H2S(g)![]() 2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如下图。
2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如下图。
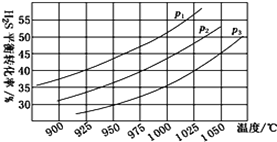
图中压强p1、p2、p3由大到小的顺序为________________________________。
②若容器的容积为2.0 L,则压强为p3,温度为950 ℃时,反应经3 h达到平衡,化学反应速率v(S2)=____。
③若压强p2=7.2 MPa、温度为975 ℃时,该反应的平衡常数Kp=__________________(用平衡分压代替平衡浓度,分压=总压×物质的量分数,结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。有人模拟用CO和H2合成甲醇,其反应为:CO(g) + 2H2(g) CH3OH(g) △H<0
(1)在容积固定为1L的密闭容器内充入2 mol CO和4 mol H2发生上述反应,20min时用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
则反应从开始到20min时,以CO浓度变化表示的平均反应速率v(CO)=_________mol/(L·min),该温度下平衡常数K=___________,若平衡后增大压强,则K值_________(填“增大”、“减小”或“不变”)。
(2)在恒温恒容的密闭容器中,不能判定CO(g)+2H2(g) CH3OH(g) △H<0,反应达到平衡的是___________;
A、压强保持不变 B、气体的密度保持不变
C、气体平均摩尔质量保持不变 D、速率v(H2):v(CH3OH)=2:1
(3)如图是甲醇燃料电池结构示意图,C是________(填“正”或“负”)极,写出此电极的电极反应式__________________________________________。

(4)若以该电池为电源,用石墨做电极电解100mL CuSO4溶液,电解一段时间后,两极均收集到11.2L的气体(标准状况下),则原CuSO4溶液的物质的量浓度为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学原理正确的是( )
A. 沸点:HF>HCl>HBr>HI
B. 一定条件下![]() 可以自发进行,则
可以自发进行,则![]()
C. 常温下,![]() 溶液加水,水电离的
溶液加水,水电离的![]() 保持不变
保持不变
D. 标况下,1mol![]() 分别与足量Na和
分别与足量Na和![]() 反应,生成气体的体积比为
反应,生成气体的体积比为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com