
【题目】I.原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计了如图所示装置。

(1)a和b不连接时,烧杯中现象是__________________。
(2)a和b用导线连接,Cu极为原电池_____(“正”或“负”)极,电极反应式为____;溶液中H+移向_____(填“Cu”或“Zn”)极。电池总反应化学方程式为_______________。
(3)若电解质溶液改为AgNO3溶液,当转移0.2mol电子时,则理论上Cu片质量变化为_____。
II.某温度下,在2 L密闭容器中,X、Y、Z三种气态物质发生化学反应时,物质的量随时间变化的关系曲线如图所示:

(1)由图中的数据分析,该反应的化学方程式为__________________。
(2)5 min内用Z表示的平均反应速率为____________。
(3)化学反应速率受到很多因素的影响,例如:实验室制取氢气时一般用粗锌替代纯锌和稀硫酸反应,这是利用________________原理加快了氢气生成的速率。
【答案】锌片逐渐溶解,锌片上有气泡冒出 正 2H++2e=H2↑ Cu Zn+H2SO4=ZnSO4+H2↑ 增加21.6g 3X+Y![]() 3Z 0.06 mol·L-1·min-1 原电池
3Z 0.06 mol·L-1·min-1 原电池
【解析】
I.a和b不连接时,锌与稀硫酸反应;a和b用导线连接,形成原电池,锌作负极、Cu作正极;若电解质溶液改为AgNO3溶液,锌作负极、Cu作正极,结合原电池原理分析解答;
II.(1)由图可知,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且5min达到平衡,根据△n(X)∶△n(Y) ∶△n(Z)计算判断方程式中各物质的化学计量数,据此书写反应的方程式;(2)结合v=![]() 计算;(3)根据影响化学反应速率的因素结合原电池原理分析解答。
计算;(3)根据影响化学反应速率的因素结合原电池原理分析解答。
I.(1)a和b不连接时,锌与稀硫酸反应,锌片逐渐溶解,锌片上有气泡冒出,故答案为:锌片逐渐溶解,锌片上有气泡冒出;
(2) a和b用导线连接,形成原电池,锌比铜活泼,锌作负极、Cu作正极,正极上氢离子放电,电极反应式为2H++2e-=H2↑,电池总反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑;原电池中,电解质溶液中氢离子向正极移动,故答案为:正;2H++2e-=H2↑;Cu;Zn+H2SO4=ZnSO4+H2↑;
(3)若电解质溶液改为AgNO3溶液,锌作负极,负极的电极反应式为Zn-2e-=Zn2+,Cu作正极,正极的电极反应式为2Ag++2e-═2Ag,当转移0.2mol电子时,Cu片上析出0.2mol Ag,Cu片质量增加了0.2mol×108g/mol=21.6g,故答案为:增加21.6g;
II.(1)由图可知,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X)∶△n(Y)∶△n(Z)=0.6mol∶0.2mol∶0.6mol=3∶1∶3,且5min达到平衡,为可逆反应,则反应的化学方程式为3X+Y3Z,故答案为:3X+Y3Z;
(2)5min内用Z表示的平均反应速率为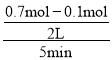 =0.06mol/(L·min),故答案为:0.06mol/(L·min)。
=0.06mol/(L·min),故答案为:0.06mol/(L·min)。
(3)实验室制取氢气时一般用粗锌替代纯锌和稀硫酸反应,反应过程中粗锌中的锌和杂质碳等与稀硫酸构成原电池,加快了氢气的生成速率,故答案为:原电池。


科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器、铁架台、试管夹均未画出)。图中A处为无水乙醇(沸点78℃),B处为绕成螺旋状的细铜丝或银丝,C处为无水CuSO4粉末,D处为碱石灰,F处为新制的碱性Cu(OH)2悬浊液。
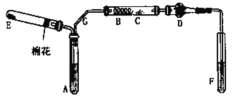
(1)为使A中乙醇平稳地汽化成乙醇蒸气,常采用的方法是_____________。
(2)若E中的固体为纯净物,则E的化学式是_____________。
(3)写出B处发生反应的化学方程式_____________
(4)加热F处的混合液的实验现象是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-水解程度增大,故碱性增强,该反应的离子方程式为_____。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3并推断Na2CO3的水解程度______NaHCO3 (填”大于”或”小于”)。丙同学认为甲、乙的判断都不充分。
丙认为: (1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则____(填”甲”或”乙”)判断正确。试剂X是____。
A.Ba(OH)2溶液 B.BaCl2溶液 C.AlCl3溶液 D.澄清石灰水
(2)查阅资料发现NaHCO3的分解温度为150℃,丙断言____(填”甲”或”乙”)的判断是错误的,理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得知,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O该组同学设计了滴定的方法测定x值。
① 称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。
② 取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③ 用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL;请回答:
(1)将草酸晶体配制成溶液时,必须用到的玻璃仪器是烧杯、玻璃棒、_____、______。
(2)滴定时,将KMnO4标准液装在右图中的________(填“甲”或“乙”)滴定管中。
![]()
(3)本实验滴定达到终点的标志是________。
(4)通过上述数据,计算出x=________。
(5)下列滴定操作会使测得的x值偏大的是________。
A.滴定终点时俯视滴定管刻度
B. 滴定终点时仰视滴定管刻度
C.滴定时所用的KMnO4溶液因久置而导致浓度变小
D.滴定管尖嘴内在滴定前有气泡,滴定后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是
A. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
B. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡:NH4HSO4(aq)![]() NH4+(aq)+H+(aq)+SO42-(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,两种碳酸盐MCO3(M表示X2+或Y2+)的沉淀溶解平衡曲线如图所示。已知:pM=-lgc(M2+),p(CO32-)=-lgc(CO32-),XCO3溶解度比YCO3大。下列说法正确的是
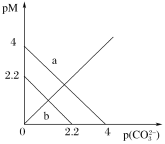
A.线b表示YCO3的溶解平衡曲线
B.a、b线上任意点均存在c(M2+)=c(CO32-)
C.t ℃时,XCO3(s)+Y2+(aq)![]() YCO3(s)+X2+(aq)平衡常数为K,其数量级为102
YCO3(s)+X2+(aq)平衡常数为K,其数量级为102
D.向YCO3悬浊液中加入饱和X(NO3)2溶液,可能有XCO3生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素位于短周期,原子序数依次增大,C基态原子核外有三个未成对电子,B与D形成的化合物BD与C的单质C2电子总数相等,CA3分子结构为三角锥形,D与E可形成E2D与E2D2两种离子化合物,D与F是同族元素。根据以上信息,回答下列有关问题:
(1)写出基态时D的电子排布图_______________________。
(2)写出化合物E2F2的电子式________,化合物ABC的结构式________。
(3)根据题目要求完成以下填空:BF32-中心原子杂化方式________;D3中心原子杂化方式________;FD42-微粒中的键角________;FD3分子的立体构型________。
(4)根据等电子原理,指出与BD2互为等电子体且含有C原子的微粒有________、________(要求写一种分子和一种离子)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com