
(14分)邻羟基桂皮酸(D)是合成香精的重要原料,下列为合成邻羟基桂皮酸的路线之一

试回答:
(1)A中含氧官能团的名称是 和 。
(2)B→C的反应类型 。
(3)D与过量NaOH溶液反应的化学方程式 。
(4)有机物E与D互为同分异构体,且E有如下特点:
① 是苯的对位取代物, ② 能与NaHCO3反应放出气体 ,③能发生银镜反应。
请写出E的一种结构简式 。
(5)下列说法正确的是 。
a.A的化学式为C7H8O2 b.B能与NaHCO3溶液反应
c.C可能发生聚合反应 d.1mol有机物D最多能与4mol H2加成
(14分)
(1)羧基 醛基 (2分) (2)消去反应 (2分,只写消去得1分)
(3) (3分,未配平扣1分)
(3分,未配平扣1分)
(4)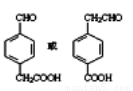 (3分,—CHO写成—COH不得分)
(3分,—CHO写成—COH不得分)
(5)cd (全对得4分,选一个且对的得2分,其它错误不得分)
【解析】
试题分析:(1)根据A的结构简式可知A中含氧官能团的名称是羧基和醛基。
(2)B→C的反应为B失去羟基和H原子,形成了碳碳双键,所以反应类型为消去反应。
(3)D中含有羧基和酚羟基,能与NaOH反应,所以D与过量NaOH溶液反应的化学方程式: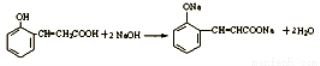
(4)①是苯的对位取代物,说明D苯环有两个取代基,位于苯环的对位;②能与NaHCO3反应放出气体,说明D含有羧基;③能发生银镜反应。说明D含有醛基,则E的结构简式为: 。
。
(5)a、根据a的结构简式可知A的化学式为C7H6O2,故a错误;b、B中不含羧基,则B不能与NaHCO3溶液反应,故b错误;c、C含有碳碳双键,能发生聚合反应,故c正确;d、D分子中含有1个苯环和1个碳碳双键,所以1mol有机物D最多能与4mol H2加成,故d正确。
考点:本题考查有机物的结构与性质、有机反应类型、化学方程式的书写、同分异构体的判断。


科目:高中化学 来源:2014-2015学年山东省济南市高三上学期期末考试化学试卷(解析版) 题型:填空题
(14分)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g) △H=—566kJmoL-1
2H2(g)+O2(g)=2H2O(g) △H=—483.6kJmoL-1
H2O(g)=H2O(l) △H=—44.0kJmoL-1
(1)写出CO和H2O(g)作用生成CO2和H2的热化学方程式:___________________________。
(2)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g) △H=—92.4kJ/mol
2NH3(g) △H=—92.4kJ/mol
当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。

①图中t3时引起平衡移动的条件可能是__________________________________________,其中表示平衡混合物中NH3的含量最高的一段时间是_____________。
②温度为T℃时,将1 mol N2和2 mol H2放入容积为0.5 L的密闭容器中,充分反应后测得N2的平衡转化率为50%。则反应在T℃时的平衡常数为____________mol-2·L2。
③目前工业合成氨的原理是:
下图表示随条件改变,平衡体系中氨气体积分数的变化趋势。

当横坐标为压强时,变化趋势正确的是(填序号,下同)__________,当横坐标为温度时,变化趋势正确的是___________。
(3)常温下氨气和HCl均极易溶于水,现将相同体积、相同物质的量浓度的氨水和盐酸混合,所得溶液中各离子的物质的量浓度按照由大到小的顺序排列依次为_______>_______>_______>________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
下列日常生活中的现象与氧化还原反应无关的是
A.铜铸塑像上出现铜绿[Cu2(0H)2C03]
B.用石膏点豆腐
C.不良商贩用硫黄熏蒸法制作“白豆芽”
D.自来水厂用氯气对水进行消毒
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省六校教育研究会高三联考化学试卷(解析版) 题型:填空题
某大型精炼铜厂,在电解铜的阳极泥中含有3-14℅Se元素,(Se和S同主族化学性质相似)以Se单质、Cu2Se存在,还含有稀有金属及贵金属。人体缺乏Se就会得“克山病”,Se也是制光电池的一种原料。从阳极泥中提取Se的流程如下:

(1)流程②的目的是_________________.流程④操作用到的玻璃仪器有烧杯、______________。
H2SeO3与SO2的离子反应方程式为 。
(2)上述工业提取Se的流程中,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是 。工业提取Se的流程中,可循环利用的物质是_________________。
(3)称取5.000g电解铜阳极泥样品以合适方法溶解,配成250.00mL混酸溶液,移取上述溶液25.00mL于锥形瓶中,加入25.00mL0.01000mol·L-1KMnO4标准溶液{只发生Se(+4)转化为Se(+6)}。反应完全后,用0.05000mol·L-1Fe2+标准溶液滴至终点,消耗15.00mL.则电解铜阳极泥中Se的质量分数为____________。若用FeCl2溶液为Fe2+标准溶液滴至终点,对测定Se的质量分数结果是否有影响,理由是_____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省六校教育研究会高三联考化学试卷(解析版) 题型:选择题
已知弱酸的电离平衡常数如下表:

下列选项正确的是
A.常温下,等浓度、等体积的NaHCO3 溶液pH小于 溶液pH
溶液pH
B.常温下,等浓度、等体积的Na2 CO3 溶液和  溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者
C.
D.水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省淮南市高三一模理综化学试卷(解析版) 题型:选择题
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。已知充电时电池总反应为:LiMn2O4=Li1-xMn2O4+xLi,下列叙述正确的是

A.放电时,正极反应为xLi++xe-=xLi
B.放电时,a极锂的化合价不发生变化
C.充电时,b极发生氧化反应
D.充电时,溶液中的Li+从b极向a极迁移
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省合肥市高三第一次教学质量检测化学试卷(解析版) 题型:填空题
(1 4分)X.Y、Z、W是元素周期表前四周期中常见的元素,原子序数依次增大,其相关信息如下表
元素 | 相关信息 |
X | 由X形成的单质是最清洁的能源 |
Y | 基态原子核外p能级电子总数比s能级少一个 |
Z | 由Z形成的多种单质,其中之一是地球生物的“保护伞” |
W | 含量位居地壳中金属元素的第二位 |
回答下列问题:
(1)Z位于元素周期表第 周期第 族,W的基态原子核外电子排布式为 。
(2)Y的第一电离能比Z (填“大”或者“小”);由X、Y、Z三种元素组成的一种盐的化学式为 。
(3)写出W元素的单质与X2Z在高温条件下反应的化学方程式 。
(4)在500℃、30MPa下,将1mol X2 与足量的Y2 置于密闭容器中充分反应生成YX3,当X2 的转化率为25%时,放出热量为7.7kJ,则该反应的热化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省攀枝花市高一上学期期末考试化学试卷(解析版) 题型:计算题
(8分)某研究小组取一定质量的镁铝合金放入200mL稀硫酸中,固体完全溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积的变化关系如图所示。

求:(1)该合金的质量
(2)原稀硫酸的物质的量浓度
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省德镇市高一上学期期末化学试卷(解析版) 题型:选择题
下列各组离子在碱性条件下能大量共存,而在强酸性条件下能发生氧化还原反应的是
A.Mg2+、Na+、SO42-、Cl— B.K+、CO32-、Cl—、NO3—
C.NH4+、Na+、SO42-、NO3— D.Na+、K+、NO3—、SO32—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com