
(8分)某研究小组取一定质量的镁铝合金放入200mL稀硫酸中,固体完全溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积的变化关系如图所示。

求:(1)该合金的质量
(2)原稀硫酸的物质的量浓度
∵加入过量NaOH溶液,最终生成的沉淀只有Mg(OH)2,
故Mg(OH)2为0.15mol(1分)
∴生成的Al(OH)3最多为0.35mol-0.15mol=0.2mol(1分)
合金中含有0.15molMg和0.2molAl
合金的质量为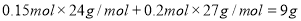 (1分)
(1分)
(2)由于加入200mL~240mLNaOH溶液时,发生反应:
NaOH+Al(OH)3=NaAlO2+2H2O
得c(NaOH)=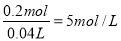 (2分)
(2分)
根据图示知:加入200mLNaOH溶液时,所得溶液中只含有Na2SO4。
溶液中含有Na2SO4: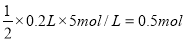 ,即SO42-为0.5mol
,即SO42-为0.5mol
所以原稀硫酸中含H2SO40.5mol(2分)
c(H2SO4)=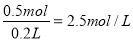 (1分)
(1分)
答:合金的质量为9g;原稀硫酸的物质的量浓度为2.5mol/L
【解析】
试题分析:根据图像分析,镁铝溶于硫酸后溶液中有硫酸镁和硫酸铝和硫酸,所以先加入氢氧化钠没有沉淀生成,当氢氧化钠的体积为20毫升时开始出现氢氧化镁和氢氧化铝沉淀,沉淀最大值为0.35摩尔,然后氢氧化铝沉淀溶于氢氧化钠,最后剩余0.15摩尔氢氧化镁沉淀,所以氢氧化铝沉淀的物质的量为0.35-0.15=0.20摩尔,从而计算合金的质量。根据200到240只有氢氧化铝和氢氧化钠反应,所以可以计算氢氧化钠的物质的量或浓度,当氢氧化钠的体积为200毫升时,溶液中只有硫酸钠,所以根据硫酸钠的化学式找硫酸和氢氧化钠的关系即可计算硫酸的浓度。
考点:金属的性质,氢氧化铝的两性。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年湖北大冶一中等六校高三元月调考理综化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍,稀释后溶液的pH=4
B.25℃时Ksp(AgCl)=1.8×10—10,向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度可能增大
C.浓度均为0.1 mol·L-1的下列溶液,pH由大到小的排列顺序为:NaOH>Na2CO3>(NH4)2SO4>NaHSO4
D.为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH >7,则H2A是弱酸;若pH<7,则H2A是强酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省淮南市高三一模理综化学试卷(解析版) 题型:填空题
(14分)邻羟基桂皮酸(D)是合成香精的重要原料,下列为合成邻羟基桂皮酸的路线之一

试回答:
(1)A中含氧官能团的名称是 和 。
(2)B→C的反应类型 。
(3)D与过量NaOH溶液反应的化学方程式 。
(4)有机物E与D互为同分异构体,且E有如下特点:
① 是苯的对位取代物, ② 能与NaHCO3反应放出气体 ,③能发生银镜反应。
请写出E的一种结构简式 。
(5)下列说法正确的是 。
a.A的化学式为C7H8O2 b.B能与NaHCO3溶液反应
c.C可能发生聚合反应 d.1mol有机物D最多能与4mol H2加成
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省合肥市高三第一次教学质量检测化学试卷(解析版) 题型:选择题
下列关于乙酰水杨酸( )说法正确的是
)说法正确的是
A.能发生水解反应 B.能发生消去反应
C.不能发生酯化反应 D.不能发生加成反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省合肥市高三第一次教学质量检测化学试卷(解析版) 题型:选择题
常温下,下列微粒在指定溶液中一定能大量共存的是
A.在能使石蕊试液变红的溶液中:Ba2+ 、Cu2+ 、NO3― 、Cl―
B.在pH=13的溶液中:K+ 、Mg2+ 、Cl―、SO32―
C.在乙醛水溶液中:K+ 、Na+ 、Cl― 、Br2
D.在由水电离c(H+)=1×10—12mol/L 的溶液中:Na+ 、K+ 、HCO3― 、CH3COO―
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省攀枝花市高一上学期期末考试化学试卷(解析版) 题型:计算题
(4分)请回答下列问题:
(1)设NA代表阿伏加德罗常数的数值,一个CO分子的质量可表示为 g。
(2)由O2和CO2组成的18 g混合气体在标准状况下的体积为11.2 L,则原混合气体的平均摩尔质量为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省攀枝花市高一上学期期末考试化学试卷(解析版) 题型:选择题
在KCl、MgSO4、MgCl2形成的混合溶液中,c(K+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.2mol/L,则c(SO42-)为
A.0.15 mol/L B.0.20 mol/L C.0.25 mol/L D.0.40 mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省德镇市高一上学期期末化学试卷(解析版) 题型:实验题
(10分)实验室以含有Ca2+、Mg2+、Cl—、SO42—、I—等离子的卤水为主要原料,制备无水CaCl2和I2。流程如下:

(1)操作Ⅰ的方法是 ,所用主要仪器的名称是 。
(2)加入溶液W的目的是除去SO42-。用CaO调节溶液Y的pH,可以除去Mg2+。酸化溶液Z时使用的试剂是______。从溶液V中再得到I2的操作方法是 。
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是 。

(4)模拟以下净化Cl2流程:Cl2 → 饱和NaCl溶液 → 浓H2SO4→纯净Cl2
设计合理实验验证H2SO3酸性强于H2CO3。
供选的试剂:CO2、SO2、Na2CO3溶液、NaHCO3溶液、NaHSO3溶液、蒸馏水、澄清石灰水、酸性KMnO4 溶液、品红溶液、pH试纸。
SO2→ → → → 。
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省德镇市高二上学期期末化学试卷(解析版) 题型:选择题
未来新能源的特点是资源丰富,在使用 时对环境无污染或者污染很小,且可以再生.下列属于未来新能源标准的是
①天然气 ② 生物质能 ③潮汐能 ④石油 ⑤太阳能 ⑥煤 ⑦风能 ⑧氢能
A.①②③④ B.②③⑤⑦⑧ C.⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com